糖化应激和抗衰老
糖化应激标志物的检测方法(3) 抗糖化作用评价
糖化应激标志物的检测方法(3) 抗糖化作用评价
自2009年秋季以来,在化妆品/美容/保健食品/抗衰老领域,以“抗糖化(anti-glycation)”为关键词的原料、产品、生活方式等开始受到人们的关注。在本文中,我们将从抗衰老医学的角度,结合具体事例介绍抗糖化作用的评价方法。
天然产物的in vitro抗糖化作用评价
评价天然产物的抗糖化作用时,将人血清白蛋白(human serum albumin : HSA)等的模型蛋白,与葡萄糖、果糖等的还原糖及评价原料(受试物)投入磷酸缓冲液(pH 7.4)中,在60℃下反应40小时。然后,在有无受试物的条件下比较反应液中的AGEs量,并计算出AGEs生成抑制率(%)。在60℃下培养HSA和葡萄糖40小时,这时AGEs 的生成水平相当于在37℃下培养约60天(图1)(1)。
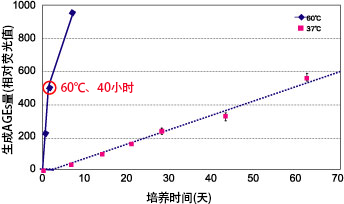
图1 人血清白蛋白/葡萄糖反应中的 AGEs生成量
人血清白蛋白(8mg/mL)+ 0.05mol/L磷酸盐缓冲液(pH 7.4)+ 葡萄糖(0.2mol/L),
在60℃(实线)、37℃(虚线)、激发波长370nm、发生波长440nm下进行检测,n=3
评价抗糖化作用时,检测来自AGEs的荧光(激发波长370 nm、发射波长 440 nm)是最简单的。荧光性AGEs包括戊糖素(pentosidine : 激发波长(ex) 335 nm / 发射波长(em) 385 nm)(2)、交联素(crossline : ex 379 nm / em 463 nm)(3)、吡咯吡啶(pyrropyridine : ex 370 nm / em 455 nm)(4)等。反应溶液中还有CML、戊糖素、3DG、GO和MGO生成,因此还可以通过各种方法检测这些产物的生成量。关于抗糖化作用,将所添加受试物的浓度设定为3个浓度及以上,使之反应后,根据各反应液中的AGEs和糖化反应中间体的检测值,计算出受试物的50%抑制浓度(50% inhibitory concentration : IC50)。
通常使用糖化反应抑制剂的氨基胍(aminoguanidine)作为AGEs生成抑制作用的阳性对照。氨基胍是一种以治疗糖尿病并发症为目的开发的药物,是阻断糖化反应中间体分子中的羰基的 AGEs生成抑制剂(5)。但在日本国内,因副作用等的影响未取得药品许可。
在in vitro抗糖化作用评价体系中,通过检测各种AGEs物质,可推测原料对复杂多路径糖化反应的作用点(6)。上述评价体系用于混合草药(7)、紫菊花(8)、维氏熊竹(9)、保健茶(10)、水果(11)等多种原料提取物的抗糖化作用筛选。据报告,虽然评价方法略有不同,但茶叶(12)、草药(13)和香料(14)、生药(15)等各种植物原料也有抗糖化作用。推测抗糖化作用主要是因为植物所含的多酚类成分。
另一方面,还有报告指出,茶树(Camellia sinensis)中所含儿茶素(catechin)、表儿茶素(epicatechin)等的黄酮类(flavonoids),以及盐肤木(Rhus javanica)的癭(五倍子)中富含的没食子酸(gallic acid)等具有儿茶酚(catechol)骨架的化合物,在10μmol/L及以下的低浓度时会抑制 CML 生成,但在1 mmol/L及以上的高浓度时会促进 CML 生成(图2)(16-17)。天然产物所含抗糖成分的作用机制尚未充分阐明,因此在使用时需要注意。
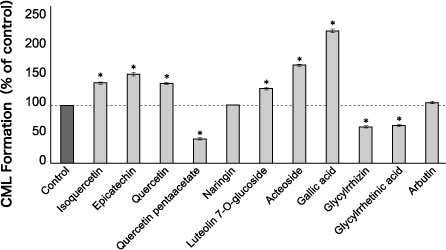
图2 天然产物的 CML生成作用
HSA 2 mg/mL + 核糖 5 mg/mL + 受试物 1 mmol/L,37℃下培养10天
CML : 利用ELISA法检测,*P < 0.01 vs control
Fujiwara Y, et al (2011)(7)
抗糖化原料的临床评价
in vitro获得抗糖化作用的评价时,将通过人体临床试验验证效果。实施临床试验时必须确保安全性。因此,作为受试食品的原料或物质,需要通过药食分类、人类食用经验调查、急性毒性试验(单次给药毒性试验)、亚急性毒性试验(重复给药毒性试验)、回复突变试验(Ames试验)、DNA修复试验(Rec-assay)和农药残留试验等确认其作为食品的安全性。另外,希望尽量查明与下列内容的相关性:所含成分的无明显损害作用水平(no observed adverse effect level : NOAEL)、未观察到作用水平(no observed effect level : NOEL)、每日允许摄入量(acceptable daily intake : ADI)、每日耐受摄入量(tolerable daily intake : TDI)。评价这些结果时,参考《保健食品安全性评价指南》(18)《片剂、胶囊剂等食品原材料的安全性自查指南》(19)《药物开发中人体首次给药试验的安全性保证指南》(20)《药品开发与提供正确信息的药物相互作用指南(草案)》(21)等。
关于人体临床试验,在明确了受试食品安全性的基础上,制定人体临床试验协议,并在获得人体试验伦理委员会的批准后,招募受试者,取得受试者的知情同意书,然后进行试验。临床试验的成败不仅取决于受试食品抗糖化作用的强弱,还受到受试者健康状况的影响。试验前,AGEs 蓄积量少且糖化应激低的受试者,因摄入抗糖化作用原料或物质而产生的变化较少。以健康人为对象进行试验时,受试者应选择无糖代谢异常等疾病、餐后血糖值高、皮肤中AGEs蓄积量多的人,换言之,以糖化应激水平高的人为对象时,容易出现抗糖化作用的影响。
抗糖化原料“AG Herb MIXTM”的研发事例
我们在有丰富食用经验的草药,且在植物分类学上属不同组的鱼腥草(Houttuynia cordata)、西洋山楂(Crataegus laevigata)、罗马洋甘菊(Chamaemelum nobile)、葡萄(Vitis vinifera)提取物中发现了对HSA的in vitro抗糖化作用(荧光性AGEs生成抑制作用),并作为抗糖化食品原料“AG Herb MIX”制成产品(22)。下文将以该原料开发为例,介绍抗糖化原料的安全性/功能性评价案例。
首先,发现通过in vitro抗糖化作用筛选获得的上述4种植物提取物对3DG、戊糖素、 CML 的生成抑制作用不同。但通过混合提取这些成分,可制成抑制各种AGEs生成的混合草药提取物。另外,还了解到混合草药提取物对牛皮源Ⅰ型胶原也具有抗糖化作用,并能同时抑制 CMA 的生成,CMA 是一种胶原特异性生成的AGEs。随后,对链脲佐菌素诱导糖尿病大鼠进行混合草药提取物给药试验,确认其与氨基胍具有同等的抗糖化作用(23)。
然后,将混合草药提取物作为AG Herb MIX制成产品,通过食用经验调查、急性毒性试验、DNA修复试验、农药残留试验等确认其食品安全性,同时取得人体试验伦理委员会的批准以及受试者的知情同意,以健康人为对象进行连续2周摄入AG Herb MIX 3,000 mg/日(摄入推荐量的5倍)的试验。其结果确认了,摄入AG Herb MIX给肝功能、肾功能、糖及脂质代谢功能、人体药物代谢功能等带来不良影响的可能性较低。
再采用相同实施步骤,以糖尿病高危人群(随测血糖值为 110~199 mg/dL 且 HbA1c(JDS值)为 5.5~6.5%)为对象,使之摄入 AG Herb MIX 3,000 mg/日或等量安慰剂食品,进行了双盲平行组间对照试验(24)。其结果证实了,在摄入开始 8 周后血糖值为 110 mg/dL及以上的亚组分析中,与安慰剂食品摄入组相比,受试食品摄入组的血中 3DG 增加有被抑制倾向(p = 0.094),在 HbA1c 5.9%及以上的亚组分析中,该组的CML 显著性降低(p = 0.048)(图3)。
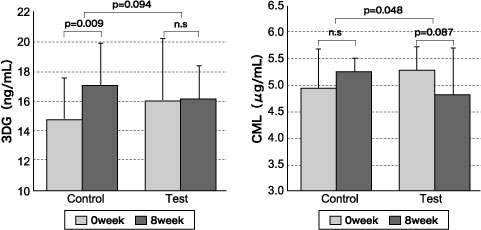
图3 摄入混合草药提取物前后的血中糖化反应产物含量变化
糖尿病高危人群(随测血糖值为110~199 mg/dL 且 HbA1c(JDS值)
为 5.5~6.5%者)中血糖值为 110 mg/dL及以上的亚组分析结果
Control : 安慰剂食品摄入组(N=8),Test : 受试食品摄入组(N=11),配对t检验
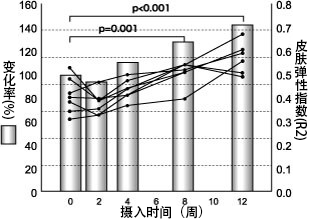
另外,在采用同样的实施步骤,以2型糖尿病患者(HbA1c(JDS值): 5.7~9.2%)为对象进行的连续12周摄入 AG Herb MIX 600 mg/日的试验(25)中,血中 3DG 在开始摄入8、12周后显著性降低(p < 0.001)。另外,血中CML 在12周后也显著性降低(p < 0.001)。关于皮肤弹性,摄入开始8周后(p = 0.001)、12周后(p < 0.001),皮肤弹性指数(R2 : Ua/Uf)显著性改善(图4)。
图4 开始摄入混合草药提取物后的皮肤弹性变化
2型糖尿病患者7名(HbA1c(JDS值): 5.7~9.2%)
R2:使用精密仪器的检测值分析参数,Dunnett多重比较检验
然后,按照相同的实施步骤,以绝经后糖化应激强的女性(摄入米饭60分钟后的血糖值和皮肤AGEs蓄积量高)为对象,进行了连续摄入8周含难消化性糊精 5 g/日 和 AG Herb MIX 100 mg/日的醋饮料(受试食品)的双盲平行对照试验(26)。结果显示,在摄入200g米饭60分钟后血糖值为150 mg/dL及以上的亚组分析中,受试食品摄入组采用胶带粘贴法检测的皮肤角质层CML量(变化比)在摄入开始8周后显著性降低(p=0.025)(图5)。
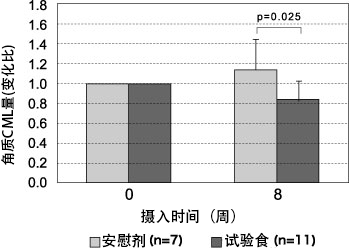
图5 摄入含有混合草药提取物的醋饮料后,角质层CML量的变化
摄入200g米饭60分钟后血糖值为150mg/dL及以上的亚组分析结果配对t检验
如上所述,临床评价必须在充分确认抗糖化作用的原料的安全性后,根据in vitro试验结果和预期作用,设定待检测评价的糖化应激标志物,拟定试验方案,并在获得人体试验伦理委员会的批准后执行。
抗糖化作用数据的表示方法
in vitro抗糖化作用通常以受试物的IC50表示,并通过与作为阳性对象的氨基胍作用比较来进行评价。但是,IC50也会因in vitro抗糖化作用评价体系中使用的蛋白和糖的种类及浓度、反应温度和时间、待测AGEs的种类不同而改变。因此,为与其他文献数据进行比较,需要使检测条件一致。并且,多数情况下天然产物中的活性成分无法进行物质鉴定,因此可基于提取液的固体含量(蒸发残渣)和总多酚量等,计算出IC50。此外,糖化反应路径有多种,生成的 AGEs 也有很多种(6)。因此,抗糖化作用的评价数据还需要另行验证原料和物质可能作用于哪个 AGEs生成途径。
最终,抗糖化作用的有用性在人体临床试验中得以确认。此时,可基于在摄入原料和物质的in vitro抗糖化作用评价中得到的作用点,选择要评价的糖化应激标志物。根据在美国实施的氨基胍的大规模临床试验结果,以及已制成产品的抗糖化原料的临床评价数据等,来设定摄入量。结果表明,当连续摄入6~36个月氨基胍,每日150mg或 300 mg时,可改善糖尿病性肾病(5)。在临床试验中,不仅显示出血中和皮肤中AGEs 的生成和蓄积抑制作用,而且在监测皮肤的张力和弹性、暗沉、肌理等皮肤指标的变化后,也显示出了对于抗糖化作用的预防衰老的有用性。
References
-
- Hori M, et al. : Anti-Aging Medicine. 2012; 9, 125-134.
- Sell DR, et al. : J Biol Chem. 1989; 264, 21597?21602.
- Obayashi H, et al. : Biochem Biophys Res Commun. 1996; 226, 37-41.
- Hayase F : Food Science and Technology Research. 2000; 6, 79-86.
- Bolton WK, et al. : Am J Nephrol. 2004; 24, 32-40.
- Takeuchi M, et al. : Journal of Alzheimer’s Disease. 2009; 16, 845?858.
- Yonei Y, et al.: Anti-Aging Medicine. 2008; 5, 93-98.
- Yagi M, et al.: Anti-Aging Medicine. 2012; 9, 61-74.
- 堀未央ら:同志社大学理工学研究. 2011; 52, 61-67.
- Hori M, et al. : Anti-Aging Medicine. 2012; 9, 135-148.
- Lanny P, et al. : Anti-Aging Medicine.2013; 10, 70-76.
- Kinae N, et al.: The maillard reaction in the food processing human nutrition and physiology. 1990; 221-226.
- Matsuura N, et al. : J Health Sci. 2002; 48, 520-526.
- Dearlove RP, et al. : J Med Food. 2008; 11, 275-281.
- Yokozawa T, et al. : J Trad Med. 2001; 18, 107-112.
- Fjiwara Y, et al. : Ann NY Acad Sci. 2008; 1126, 152?154.
- Fujiwara Y, et al. : Free Radical Biology & Medicine. 2011; 50, 883?891.
- (財) 日本健康・栄養食品協会. 2008.
- 厚生労働省 : 食安発第0201003号. 2010.
- 厚生労働省 : 薬食審査発0402第1号. 2012.
- 厚生労働省 : 意見募集, 案件番号495130206号. 2013.
- 八木雅之ら : COSMETIC STAGE. 2011; 15, 23-32.
- Yonei Y, et al. : Anti-Aging_Medicine. 2008; 5, 93-98.
- Yonei Y, et al. : Anti_Aging_Medicine. 2010; 7, 26-35.
- Kubo M, et al. : J Clin Biochem Nutr. 2008; 43(suppl 1), 66-69.
- Yagi M, et al. : Glycative Stress Research. 2014; 1, 14-24.
Glycative stress and Anti-aging
- 什么是糖化应激?
- 糖化应激标志物的检测方法(1) 血糖、糖化蛋白、糖化反应中间体的检测
- 糖化应激标志物的检测方法(2) AGEs的检测
- 糖化应激标志物的检测方法(3) 抗糖化作用评价
- 糖化应激和AGEs受体
- 糖化应激与肾疾病
- 糖化应激和皮肤老化
- 糖化应激与动脉硬化
- 糖化应激和精神分裂症
- 糖化应激与肝病
- 糖化应激与不孕症
- 糖化应激与阿尔兹海默症
- 糖化应激对策(1) 血糖控制
- 糖化应激对策(2) 糖化反应的抑制
- 糖化应激对策(3) AGEs的降解和排泄
- 糖化应激对策(4) 膳食来源的AGEs
- 糖化应激对策的课题和展望