学術情報
生体内コラーゲンと代謝サイクル
生体内コラーゲンと代謝サイクル
体の中のコラーゲン
生体中のコラーゲンは、細胞外で線維状として存在することを特徴としており、生物の体を作るタンパク質成分として多彩なはたらきをしています。一般にタンパク質の大部分は生体中で球状を示し、水に溶けた状態で存在しています。しかしコラーゲンは線維状あるいは膜状の構造体を作り、水に溶けない状態で存在しています。このため、さまざまな臓器や体の形を作り、支え、頑丈にすることや、臓器と臓器を結合させて境界を作るはたらきをしています。特に、皮膚、腱、軟骨、骨、血管壁、歯などには多量に存在しています(表1)。
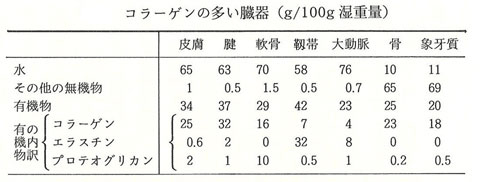
表1. コラーゲンの多い臓器
藤本大三郎(コラーゲン, 1994)より
皮膚や腱ではそこに含まれる有機物の70~85%(湿重量比)をコラーゲンが占めています。強さと柔軟さを兼ね備える皮膚、骨と筋肉を引っ張る力を伝える腱、硬さとしなやかさを持つ骨など、コラーゲンは線維化することで多様なはたらきを示します。さらにコラーゲンは細胞の足場となるはたらきも持っています。体の細胞は血液中に浮遊している血球などを除くと、細胞と細胞が寄り集まって存在しています。コラーゲンは、細胞と細胞の隙間を埋めることで足場を作り、細胞の分化、増殖、形態や器官の形成などに深いかかわりを持っています。このためコラーゲンの不足や過剰は体にさまざまな影響を与えます。
コラーゲンの代謝サイクル
コラーゲンは主に間葉性細胞に属する線維芽細胞、骨芽細胞、軟骨芽細胞、象牙芽細胞、線維随伴細胞などによって合成されます。また上皮細胞や平滑筋細胞にもコラーゲン合成能があると言われています。線維芽細胞やその他の細胞で合成されるコラーゲンはプロコラーゲン(procollagen)の状態で細胞外に分泌された後、重合化して線維が形成されます(図1)。
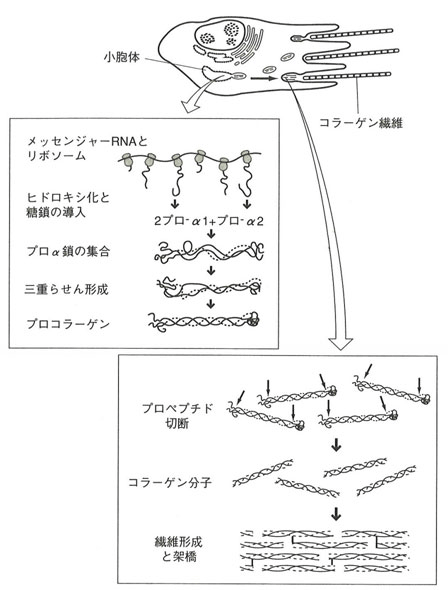
図1. 生体中コラーゲンの合成
藤本大三郎(コラーゲン物語, 2006)より
まず、細胞内粗面小胞体上のポリソーム(リボゾーム)で合成されたプロコラーゲンは、凝集することなく細胞内を通過して細胞外に放出されます。プロコラーゲンは、細胞外で酵素(procollagen peptidase)分解によってN末端ペプチドの一部が切断され、プロトコラーゲンに変わります。プロトコラーゲンからコラーゲン線維の形成には、酸素、鉄イオン(Fe2+)、アスコルビン酸及び α-ケトグルタル酸が必要になります。プロトコラーゲンでは、ペプチド鎖中の特定のプロリンとリジンが各ヒドロキシラーゼの作用により水酸化されます。その後コラーゲン線維内のヒドロキシプロリンは3本のペプチド鎖間に水素結合を形成して、らせん構造を安定化させます。さらにヒドロキシリジンとリジンはリジルオキシダーゼのはたらきによって分子間に架橋結合(アルドール結合による成熟架橋)を形成し、コラーゲン組織特有の強い線維構造を作ります。
コラーゲンは化学的に安定なタンパク質であり、皮膚や骨、関節などに存在する場合、長期間分解しません。これはコラーゲンが持つ特有のアミノ酸配列構造、架橋結合、3重らせん構造が酵素分解を受けにくいためと考えられています。健康なヒト組織中のコラーゲンは皮膚で15年、軟骨で117年の半減期を有すると報告されています(Verzijlら, 2000)。しかし発育期や創傷治癒時の結合組織ではコラーゲンの生成・分解が盛んに行われ組織が再生されます。コラーゲンを分解する生体内酵素にはコラゲナーゼおよびMMP(マトリックスメタプロテアーゼ)ファミリーと呼ばれる酵素群があります。コラーゲンの生成・分解は、炎症の強さ、ホルモン量などの影響を受けることが、線維芽細胞を使った実験で確かめられています。しかし生体内での関与については未解明な部分が多々あります。
このようにコラーゲンは古くから利用され、重要な生体化合物でありながら未解明な部分が多いタンパク質の1つです。
参考文献
- 藤本大三郎: 未来の生物科学シリーズ32 コラーゲン, 110pp, 共立出版, 1994.
- 藤本大三郎: 科学のとびら38 コラーゲン物語, 161pp, 東京化学同人, 2006.
- 大﨑茂芳: コラーゲンの話 健康と美をまもる高分子, 中公新書, 2007.
- 服部俊治: コラーゲンの構造と応用展開, BIO INDUSTRY, 16(7), 22-33, 1999.
- 石見佳子: コラーゲンの安全性と機能性, 食品成分有効性評価及び健康影響評価プロジェクト解説集, 2004/11/04, 国立健康・栄養研究所ホームページ
- Verzijl N. et al.: Effect of collagen turnover on accumulation of advanced glycation end products, J.Biol.Chem, 274(50), 39027-39031, 2000.
