学術情報
コラーゲンの老化と疾患
コラーゲンの老化と疾患
コラーゲンの老化と疾患
コラーゲン線維の引っ張り強度は生後加齢と共に上昇し、成熟するとほぼ一定になります。これは、コラーゲンが強度を保つために形成するコラーゲン分子内および分子間のヒドロキシリジンによる架橋(成熟架橋)を形成し終えることによるものです。
また、20歳を過ぎる頃から加齢に伴い、コラーゲン中のAGEs蓄積の増加や分解性が低下します(図1, 2: Verzijl ら, 2000)。この要因の1つには、コラーゲンが他のタンパク質と比べて代謝回転が遅いため、ヒトがエネルギー源として利用しているグルコースによって糖化反応が起こり、分子内にAGEsの蓄積や成熟架橋以外の糖化架橋(老化架橋)の形成が関係しています。
老化架橋は皮膚に「はり」を無くし、関節を硬くし、血管が硬くなるなどの老化現象に関わると考えられています。
さらにマウス培養細胞を用いた実験から、コラーゲン線維の糖化が線維芽細胞の足場になる機能を低下させることが明らかになっています(藤本, 1994)。
細胞はコラーゲンを少しずつ生産して分泌すると同時に、少しずつ分解してゆっくりと代謝回転しています。加齢に伴い細胞やコラーゲンが老化すると、コラーゲンの代謝回転が一層遅くなり、生体の老化現象やさまざまな疾患を発症・進展させることになることになります。
特にコラーゲンの糖化は、皮膚(肌のはり低下)、骨(骨粗鬆症、骨強度低下)、関節(変形性関節症)などの老化や疾患の進展と深く関係しています。老化現象や老化疾患の発症・進展を予防するためには、コラーゲンの糖化リスクを低減させることが重要なポイントになります。
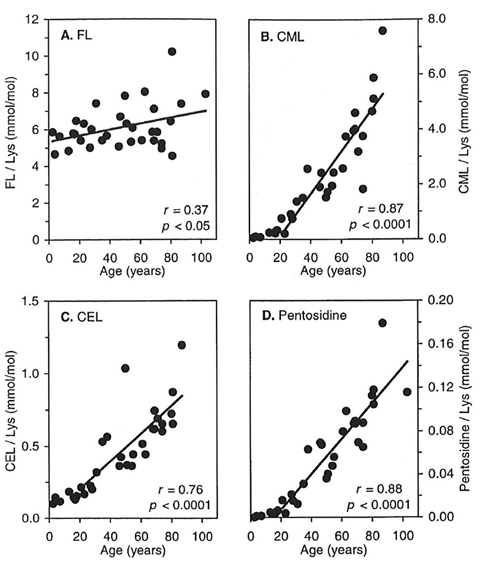
図1. 加齢に伴うヒト軟骨コラーゲン中の各種AGEsの蓄積量
Verzijl ら, Biochem. J., 2000 より
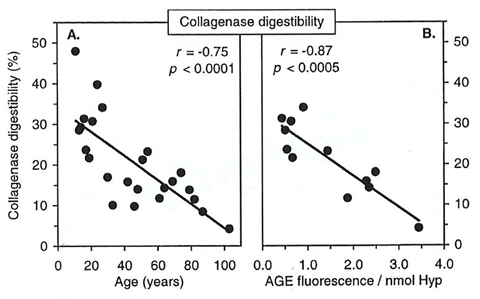
図2. ヒト軟骨コラーゲンの加齢およびAGEs量とプロテアーゼによる分解性の変化
Verzijl ら, Biochem. J., 2000 より
皮膚老化
ヒトの皮膚組織は体の外側から表皮、真皮、皮下組織の3層からできています。
コラーゲンは真皮に存在し真皮中に存在する線維芽細胞でつくられます。真皮中のコラーゲンは、皮膚組織の乾燥重量の70%を占め、「はり」を与えています。このため、皮膚コラーゲン量の低下や変性は老化を促進させる原因になります。
実際に、皮膚中コラーゲン量は加齢に伴って40歳以降、年齢と共に有意に低下します(図3: Castelo-Branco ら, 1994)。これはコラーゲンの分解量が合成量を上回るためと考えられています。
また加齢に伴い皮膚中のAGEs蓄積量が増加すること(Jeanmaire ら, 2001)や、血糖管理を指導しなかった糖尿病患者の皮膚コラーゲン中AGEsの蓄積量が、指導した糖尿病患者より多いこと(Genuth ら, 2005)、さらに糖尿病患者の皮膚弾力が健常者と比べて低下していること(Kubo ら, 2008)も報告されています。
皮膚の「はり」低下は、自分自身の老化に気づくきっかけになる変化の1つです。特に顔の皮膚老化は容貌の変化を伴うため、QOLを著しく低下させる原因になっています。
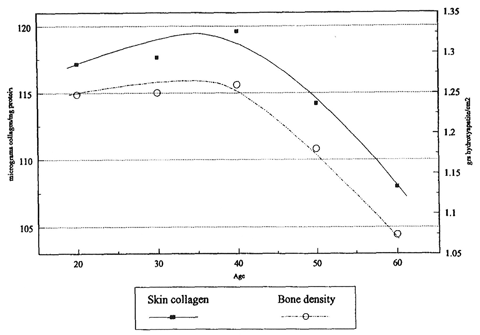
左軸(-●-): 皮膚コラーゲン量(μg コラーゲン/mg タンパク質)
右軸(—○—): 骨密度(g ヒドロキシアパタイト/cm2)
図3. 加齢に伴うヒト皮膚中コラーゲン量と骨密度の変化
Castelo-Branco C. ら, Maturitas, 1994 より
骨粗鬆症・骨強度低下
日本の骨粗鬆症患者は1,100万人と推定されています。また、ヨーロッパとアメリカを含めると7,500万人以上が骨粗鬆症に罹患していることから、世界中の人々の健康にとって、骨粗鬆症は大きな脅威になっています。
ヒトの骨におけるコラーゲン含有量は重量あたりでは約20%ですが、体積あたりでは約50%になり、残りの成分はカルシウムなどのミネラルです。骨強度は骨密度と骨質によって決まり、骨に含まれるコラーゲンが強度因子である骨質に重要な役割を果たしています。
骨のコラーゲン分子は細胞外に分泌された後、コラーゲン架橋(善玉架橋=成熟架橋)と呼ばれる構造が形成され、コラーゲン線維の強度発現に作用します。一方、コラーゲン分子に糖化や酸化などによる無秩序な架橋(悪玉架橋=老化架橋)が形成すると、骨のしなやかさが失われ骨強度が低下します(図4: 斎藤, 2006)。
2000年に開催されたNIHコンセンサス会議において骨粗鬆症は「骨強度の低下を特徴とし、骨折リスクが増大しやすくなる骨格疾患」という定義に改訂されました。骨強度には骨密度と骨質の両方が関与します。
また、骨粗鬆症治療薬を用いても、骨折リスク低下に対する骨密度増加の寄与する割合は4~30%であり、骨質が骨強度因子として見直されています。
実際に骨吸収マーカーは低値であるにもかかわらず大腿骨頸部骨折症に至った患者で、悪玉架橋に関与するAGEsの一つである骨中ペントシジンが高値になって過老化状態に陥った例が報告されています。本症例からも骨粗鬆症に伴う骨の脆弱化は、骨代謝に起因する骨量の低下のみで説明できないことが明らかになってきています。このため、骨コラーゲンの糖化およびAGEs蓄積抑制が骨粗鬆症の新たな治療・予防に繋がると考えられています。
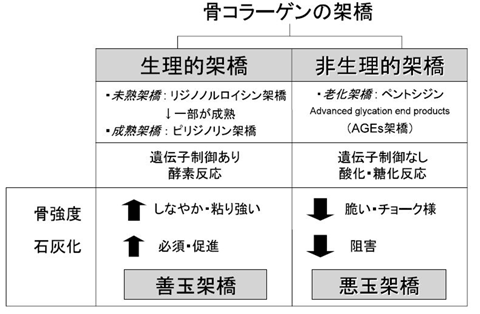
図4. 骨コラーゲンの架橋の分類と善玉架橋・悪玉架橋の概念
斎藤 充, CLINICIAN, 2006 より
変形性関節症
変形性関節症(OA: osteoarthritis)は、社会の高齢化に伴い急激に増加している疾患の一つで、日本に800万人の罹患者がいると推定されています。
OAの危険因子は年齢であり、加齢に伴う軟骨細胞と基質の変化が発症に関与しています。
軟骨基質の主な構成要素として、Ⅱ型コラーゲンとプロテオグリカンがあります。これらの代謝は極めて遅く、関節軟骨における半減期が、コラーゲンで100年以上、プロテオグリカンで20年前後と推定されています。特にコラーゲンは組織中に長期間存在するためさまざまな化合物により修飾を受けます。
AGEsは最も病的関与が大きいと考えられている蓄積化合物群の一つです(福井, 2006)。実際にヒト関節軟骨でペントシジン蓄積レベルに応じた軟骨基質の弾力低下(Bank ら, 1998)や、軟骨細胞がAGEsの受容体であるRAGEを発現させ、炎症性サイトカインやMMPの産生を誘導することが確認されています。
さらに軟骨基質のAGEs化は、軟骨細胞との正常な相互作用を阻害し、AGEsの蓄積に伴うプロテオグリカン産生を低下させます(図9: DeGroot ら, 1999)。また、イヌを使った実験ではAGEsの蓄積に伴うOAの進行加速が観察されています(DeGroot ら, 2004)。
現在、OAの治療にはヒアルロン酸の関節内直接注入が広くおこなわれています。今後は糖化およびAGEsの蓄積の抑制が、変形性関節症の治療や予防に役立つと考えられています。
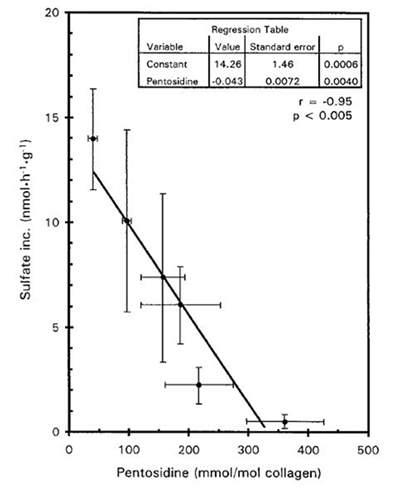
縦軸:培養組織への硫酸イオンの取り込み量から算出したプロテオグリカンの合成能
横軸:組織中のペントシジン量
平均年齢71.7±3.4歳
図4. ヒト関節軟骨中コラーゲンのAGEs量とプロテオグリカン合成能
DeGroot J ら, Arthritis Rheum, 1999 より
参考文献
- 藤本大三郎: 未来の生物科学シリーズ32 コラーゲン, 110pp, 共立出版, 1994.
- 藤本大三郎: 科学のとびら38 コラーゲン物語, 161pp, 東京化学同人, 2006.
- 大﨑茂芳: コラーゲンの話 健康と美をまもる高分子, 中公新書, 2007.
- 服部俊治: コラーゲンの構造と応用展開, BIO INDUSTRY, 16(7), 22-33, 1999.
- 石見佳子: コラーゲンの安全性と機能性, 食品成分有効性評価及び健康影響評価プロジェクト解説集, 2004/11/04, 国立健康・栄養研究所ホームページ
- Verzijl N. et al.: Effect of collagen turnover on accumulation of advanced glycation end products, J.Biol.Chem, 274(50), 39027-39031, 2000.
- Bank R.A. et al.: Aging and zonal variation in post-translational modification of collagen in nomal human articular cartrige, Biochem.J., 330, 345-351, 1998.
- Castelo-Branco C. et al.: Relationship between skin collagen and bone changes during aging, Maturitas, 18(3), 199-206, 1994.
- Jeanmaire C. et al.: Glycation during human dermal intrinsic and actinic ageing: an in vivo and in vitro model study, Br.J.Dermatol, 145, 10-18, 2001.
- Genuth S. et al.: Glycaton and carboxymethyllysine levels in skin collagen predict the risk of future 10-Year progression of diabetic retinopathy and nephropathy in the diabetes control and complications trial and epidemiology of diabetes interventions and complications participants with type 1 diabetes, Diabetes, 54, 3103-3111, 2005.
- Kubo M. et al.: Anti-glycation effects of mixed-herb-extracts in diabetes and pre-diabetes., Journal of Clinical Biochemistry and Nutrition, 43(Suppl 1), 66-69, 2008.
- 斎藤 充: コラーゲン代謝と骨粗鬆症, CLINICIAN, 119, 1141-1146, 2006.
- 福井尚志: 変形性関節症の病態 軟骨基質からみた発症と進行のメカニズム, Cartilage, 2006.
- DeGroot J. et al.: Age-related decrease in proteoglycan synthesis of human articular chondrocytes, Arthritis Rheum, 42(5), 1003-1009, 1999.
- DeGroot J. et al.: Accumulation of advanced glycation end products as a molecular mechanism for aging as a risk factor in osteoarthritis, Arthritis Rheum, 50(4), 1207-1215, 2004.
