学術情報
肥満と慢性炎症に及ぼすポリメトキシフラボノイドの作用
肥満と慢性炎症に及ぼすポリメトキシフラボノイドの作用
慢性炎症とは
慢性炎症は、肥満、メタボリックシンドローム、動脈硬化性疾患などの生活習慣病、およびがんに共通する病態で、アルツハイマー病、腎不全、肝硬変などでも重要な因子と考えられています。
炎症は重要な生体防御機能の1つで無くてはならないものですが、不必要あるいは過剰(長期)な炎症反応は、疾患を増悪させたり新たな疾患を引き起こしたりします。
急性炎症では発熱、腫れ、痛み、赤みなどの炎症反応が起きますが、慢性炎症では、ほとんど確認できません。これを「くすぶったような」非常に低いレベルの炎症と表現されています。予後については、急性炎症が多くの場合は可逆的であり、組織の再構築にまでは至らずに治癒するのに対し、慢性炎症は、組織が繊維化したり、マクロファージなどの炎症細胞が入ってきて、組織の細胞が肥大・増殖して構造が変わり、機能障害を引き起こしたりします。
慢性炎症の原因となるものには、内因として、脂肪細胞の肥大化、動脈硬化、自己免疫などが、外因として、毒性の弱い微生物(結核菌や真菌など)による持続的な感染、毒性の弱い異物(アスベストなど)が肺に吸入された場合などがあります。
表1は、メタボリックシンドローム関連の臨床検査項目と高感度CRP(動脈硬化などの慢性炎症のマーカー)との相関性について調査した結果です。肥満、内臓脂肪、糖尿病、脂質異常症および高血圧のマーカーが、慢性炎症マーカーと有意な相関があり、これらの疾患に慢性炎症が深く関わっていることがわかります。
表1.各臨床検査項目と高感度CRPとの相関係数(n=407)
| 項目 | r | p値 |
|---|---|---|
| 年齢 | 0.021 | NS |
| 身長 | 0.071 | NS |
| 体重 | 0.305 | 0.00001 |
| BMI | 0.322 | 0.00001 |
| 腹囲 | 0.317 | 0.00001 |
| ヘモグロビンA1c | 0.287 | 0.00001 |
| 総コレステロール | 0.121 | 0.024 |
| LDL-C | 0.106 | 0.046 |
| トリグリセリド | 0.142 | 0.0042 |
| HDL-C | -0.114 | 0.021 |
| 収縮期血圧 | 0.089 | NS |
| 拡張期血圧 | 0.148 | 0.003 |
現在、慢性炎症に重要な役割を果たす生体内の因子として、KLF(東京大学)、TLR(東京医科歯科大学)、ANGPTL(熊本大学)などが発見確認され、慢性炎症の発症メカニズムや病態、治療法、予防法などに関する研究が行われています。
肥満と慢性炎症との関係
肥満の脂肪組織では慢性炎症が起きています(図1)。脂肪細胞が肥大化し、マクロファージやリンパ球などの免疫細胞がたくさん入ってきて、血管が新生され、細胞外マトリクスが過剰産生されるなど組織が再構築されて、脂肪組織の機能障害に至ります。それは、アディポサイトカインを産生し調節する機能が十分に働かず、メタボリックシンドロームへ進展していくことを意味します。
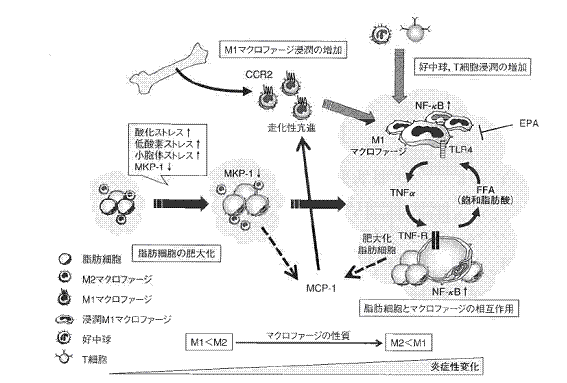
図1.肥満の脂肪組織における炎症性変化
肥満の脂肪組織では脂肪細胞の増殖・肥大化、マクロファージ浸潤の増加、脂肪細胞とマクロファージの相互作用による炎症性変化が肥満の病態形成、ひいてはメタボリックシンドロームの進展に寄与していると考えられる。同時に、肥満の脂肪組織には好中球やT細胞が浸潤するという。
(出典:伊藤綾香ら:Adiposcience 6(1):16-21, 2009)
これらのメカニズムを単純化して説明すると以下のようになります。
- 肥満により脂肪細胞が肥大化し、MCP-1を放出する。
- MCP-1によって単球が脂肪組織に入り、マクロファージとなる。
- 肥大化した脂肪細胞とマクロファージが相互作用することにより、炎症反応の悪循環が発生し(慢性炎症)、炎症性サイトカイン(TNF-α、IL-6など)が産生され、血液に入って全身に運ばれる。
- 炎症性サイトカインは、血管では動脈硬化を進展させるなど、全身に悪影響を及ぼす。
- 一方、肥大化した脂肪細胞からはアディポネクチンの分泌が減少する。
- その結果インスリン抵抗性となり、組織でのグルコースの取り込みが減少する。
- 血糖値が上昇して全身で糖化が促進されるなど、糖代謝異常を生じる。
- 以上の結果、メタボリックシンドロームへ進展する。
慢性炎症が関係する疾患
慢性炎症が関係する疾患は多岐にわたっています。図2のとおり、慢性炎症はメタボリックシンドロームを基盤とする生活習慣病、動脈硬化性疾患、がんの発症・浸潤・転移、自己免疫疾患、神経変性疾患などで発生していて、重症化にも深くかかわっています。
この原因として、長期にわたるストレス応答のために実質細胞と多様な間質細胞の相互作用が遷延化し、適応の破綻により不可逆的な「組織リモデリング」を生じて臓器の機能障害をもたらす、とされています。
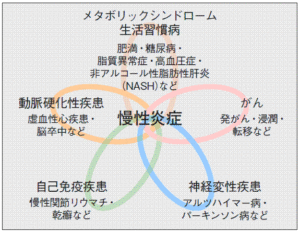
図2.慢性疾患、がんの基盤病態・慢性炎症
(出典:Medical Tribune 2010年2月11日号:p39)
慢性炎症と強い関連のあるがんとしては、慢性潰瘍性大腸炎やクローン病と大腸がん,C型肝炎ウイルス感染で起こる慢性肝炎と肝細胞がん,住血吸虫の感染により起こる膀胱,大腸がん,ピロリ菌感染で発生する胃がん、ヒトパピローマウイルスによる子宮頸がんなどがあります。
ポリメトキシフラボノイドの抗炎症作用
本章で紹介する研究報告等のポリメトキシフラボノイドは以下のとおりです。
- ノビレチン
- ノビレチンの代謝物
- タンゲレチン
- ナツダイダイン
- 3,5,6,7,8,3’,4’-ヘプタメトキシフラボン
- タンカン、ケラジミカン、ポンキツおよびシイクワシャーの抽出物
これらには全て抗炎症作用が認められ、多くで腫瘍壊死因子-α(TNF-α)の抑制が確認されています。
(1)ノビレチン
- マウスマクロファージにおいて、リポポリサッカライドによって誘発されるプロスタグランジンE2の産生をノビレチンが抑制しました。
- 同様に、誘発される炎症メディエータ、インターロイキン(IL)-1α、IL-1β、TNF-αおよびIL-6の発現をノビレチンが抑制しました。
(2)ノビレチンの代謝物
- マウスのノビレチン尿中代謝物である、モノ脱メチル化物(3′-デメチルノビレチンと 4′-デメチルノビレチン)およびジ脱メチル化物(3′,4′-ジデメチルノビレチン)は、RAW264.7マクロファージにおいて、リポポリサッカライドによって誘導されるNO産生とiNOS、シクロオキシゲナーゼ-2(COX-2)タンパク質発現を抑制しました。
- このときNO産生抑制活性の比較では、ノビレチンにはその活性がほとんど認められず、脱メチル化物の効力がノビレチンの効力を大きく上回りました(図3)。
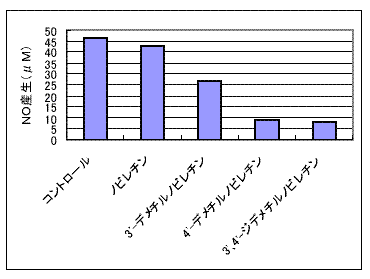
図3.NO産生に対するノビレチンとその代謝物の抑制効果
(出展:矢野昌充:果樹試験研究推進協議会会報 7:9-10, 2008)
(3)タンゲレチン
- タンゲレチンは、ヒト肺がん細胞でp38 MAPK、JNKおよびAKTの活性化の阻害により、IL-1βによって誘発されるCOX-2発現を抑制しました。
- ヒト肺がん細胞のIL-1βによって誘発されたCOX-2発現のタンゲレチンによる阻害が、少なくとも一つは、ERKではなく、p38 MAPK、JNKとPI3Kのシグナリングタンパク質の抑制と同様にNF-κB転写因子の抑制を介した可能性があります。
(4)ナツダイダイン
- ナツダイダインは、ラット好塩基球性白血病細胞のTNF-αとCOX-2発現を抑制しました。
- これらの結果はナツダイダインが、p65 NF-κBリン酸化でなく、p38 MAPKリン酸化を抑制することによってTNF-αとCOX-2産生を阻害することを示唆しました。
(5)3,5,6,7,8,3’,4’-ヘプタメトキシフラボン
- 3,5,6,7,8,3’,4’-ヘプタメトキシフラボン(HMF)は、ヒト単球のTNF-αの発現を抑制しました。
- HMFがホスホジエステラーゼ活性を抑制することによって、サイトカイン産生を阻害することが示唆されました。
- HMFがIL-10産生を阻害したことから、ホスホジエステラーゼに依存しないメカニズムが別に存在することを示唆しました。
(6)タンカン、ケラジミカン、ポンキツおよびシイクワシャーの抽出物
- マウス培養細胞(J774.1)を用いた機能性評価において、タンカン、ケラジミカン、ポンキツおよびシイクワシャーの果皮抽出物は、炎症の指標である炎症性サイトカインTNF-αの産生を濃度依存的に抑制し、炎症抑制機能が認められました(図4)。
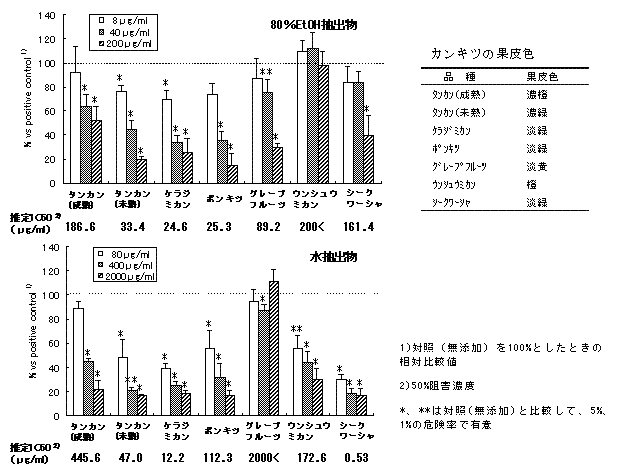
図4.カンキツ果皮抽出物添加がTNF-α産生に及ぼす影響
(出展:鹿児島県特産カンキツの腫瘍壊死因子の産生抑制機能(農研機構))
- タンカンの果皮水抽出物には、抗炎症成分の一つとしてポリメトキシフラボノイドのノビレチンが含まれることが確認されました(図5)。
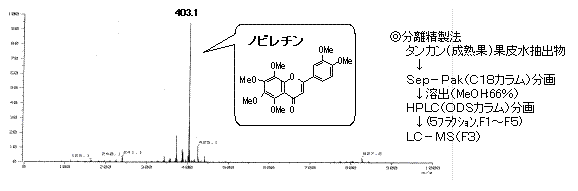
図5.タンカン果皮水抽出物画分F3のLC-MSクロマトグラムと構成成分
(出展:鹿児島県特産カンキツの腫瘍壊死因子の産生抑制機能(農研機構))
抗炎症作用のメカニズムとPPARγの関係
マクロファージからの炎症性サイトカインの産生を引き起こす主要な刺激はTLRという受容体からのシグナルです。脂肪組織では、TLR4(前出図1参照)が脂肪細胞から放出された遊離の飽和脂肪酸をシグナルとするNF-κB活性化経路があります(図6)。慢性炎症で発生している悪循環(遊離(飽和)脂肪酸→NF-κB→TNF-α→遊離(飽和)脂肪酸・・・)を断ち切るためには、循環している経路のどこかを抑制する必要があります。
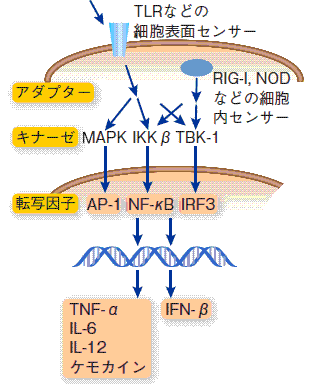
図6.サイトカインの産生機構(マクロファージ)
(出典(一部改変):吉村昭彦:細胞工学 28(11):1086-1093, 2009)
ところで、PPARγアゴニストはNF-κBの活性化を抑制して、単球やマクロファージのサイトカイン産生を制御し、抗炎症作用を発揮します(図7)。また、PPARγアゴニストは自己免疫性疾患、炎症性腸疾患、気道炎症、関節炎、膵炎などでの有効性も報告され、PPARγが新たな炎症治療のターゲットとして注目されています。
一方、ノビレチンにはPPARγを活性化する作用が認められており、PPARγアゴニストとして推測されています。また、他のポリメトキシフラボノイドも化学構造の類似性からPPARγを活性化することが予測されています。従って、ポリメトキシフラボノイドの抗炎症作用のメカニズムは、PPARγリガンドとしての作用の可能性が高いのではないかと考えられます。

図7.PPARγアゴニストによる抗炎症作用メカニズムの概略
(出典:和田孝一郎ら:日本臨牀 68(2):278-283, 2010)
PPARγアゴニストは直接、あるいはPPARγの活性化を介してNF-κBの活性化を抑制する。また、PPARγによるアディポネクチンの発現増加も炎症反応の増幅を抑制する。
まとめ
本章のまとめは以下のとおりです。
①慢性炎症は、メタボリックシンドロームなどの多くの疾患に関与しています。
②肥満による脂肪細胞の肥大化は、脂肪細胞の慢性炎症の原因となっています。浸潤したマクロファージと脂肪細胞の相互作用が悪循環となり、慢性炎症が進展します。
③一方、多くのポリメトキシフラボノイドに抗炎症作用が認められています。
④ポリメトキシフラボノイドの抗炎症作用のメカニズムは、PPARγアゴニストによるものと同様と考えられます。
⑤ポリメトキシフラボノイドの緩和な抗炎症作用は、低いレベルで進展する慢性炎症の改善に寄与することが期待されます。
本章は慢性炎症の概論をメタボリックシンドロームを中心に述べましたが、この後の章では、肝炎や関節炎について個々に説明いたします。
参考文献
- 吉金秀樹ら:J Cardiol 50(3):175-182, 2007
- 伊藤綾香ら:Adiposcience 6(1):16-21, 2009
- 山内敏正ら:医学のあゆみ 229(7):512-518, 2009
- Medical Tribune 2010年2月11日号:p39
- 髙山昭三ら:モダンメディア 51(4):91-93, 2005
- Ishiwa J, et al.:J Rheumatol. 27(1):20-25, 2000
- Lin N, et al.:Biochem Pharmacol. 65(12):2065-2071, 2003
- Li S, et al.:Bioorg Med Chem Lett. 17(18):5177-5181, 2007
- 矢野昌充:果樹試験研究推進協議会会報 7:9-10, 2008
- Chen KH, et al.:Biochem Pharmacol. 73(2):215-227, 2007
- Matsui T, et al.:J Pharm Pharmacol. 61(1):109-114, 2009
- Manthey JA, et al. :J Nat Prod. 62(3):441-444,1999
- 岡田大士ら:日本食品科学工学会誌 50(9):435-438, 2003
- 農林水産研究情報総合案内
- 吉村昭彦:細胞工学 28(11):1086-1093, 2009
- 和田孝一郎ら:日本臨牀 68(2):278-283, 2010
- 内藤裕二ら:日本臨牀 68(2):341-349, 2010
