学術情報
コラーゲンとは
コラーゲンとは
コラーゲンとは
コラーゲン(collagen)は全ての多細胞動物に存在する細胞外マトリックスタンパク質です。ヒトでは生体内に存在する全タンパク質の約30%がコラーゲンで占められています。コラーゲンはその物理化学的性質から構造や機能の異なる分子ファミリーに分けられ約30種類の型があります(図1)。各型名はほぼ発見順に付けられた番号です。
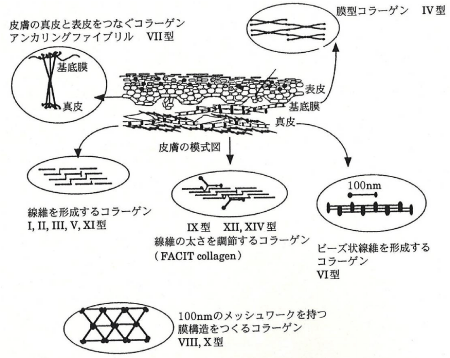
図1. コラーゲンの型
服部俊治(BIO INDUSTRY, 1999)より
コラーゲンは古くから皮革や膠(にかわ)として人類に利用されてきた天然材料の1つです。またコラーゲンの変性物であるゼラチンは食品や写真フィルムなどに広く応用されています。最近、コラーゲン、ゼラチン、コラーゲンペプチドという用語を区別せず、いわゆるコラーゲンとして同等に使われていますが、物理化学的な性質は異なります。
コラーゲンの構造とその仲間
コラーゲンの構造は存在量が最も多いⅠ型コラーゲンの場合、分子量10万でアミノ酸残基数1,000程度のポリペプチド鎖(α鎖)が3本で三重らせん構造を作り、分子量約30万、長さ約300nm、直径約2nmの細長い棒状のタンパク質です(図2)。
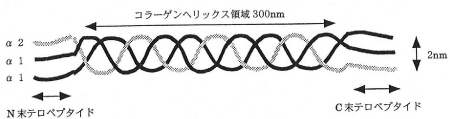
図2. 1型コラーゲンの構造と線維
服部俊治(BIO INDUSTRY, 1999)より
分子内にはコラーゲン特有のらせん(ヘリックス)構造領域と10残基程度のヘリックス構造を持たないN、C末端の領域(テロペプチド)があります。各鎖のアミノ酸配列は3残基ごとにグリシンが存在し、一般式として(グリシン-X-Y)nとして表されます。
X位置はプロリン、Y位置はヒドロキシプロリンであることが多く、この2種類のアミノ酸が全残基の20~25%を占めます。また、XまたはYの位置にヒドロキシリジンが入る場合はリジルオキシダーゼにより酸化された後、各鎖間に架橋結合が形成されてタンパク質の立体構造が維持されます(図3)。
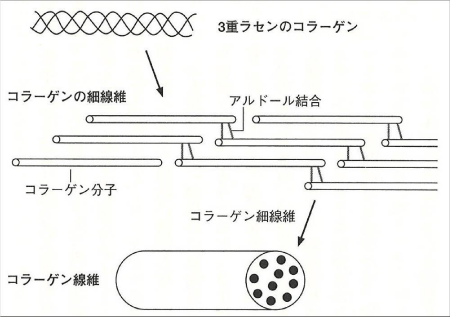
図3. コラーゲン分子間の架橋形成
大﨑茂芳(コラーゲンの話, 2007)より
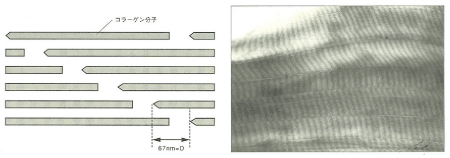
図4. コラーゲン線維の構造(左:模式図、右:電子顕微鏡像写真)
藤本大三郎(コラーゲン物語, 2006)より
コラーゲン分子は1分子の約1/4にあたる67nmごとに規則的にずれて線維束を形成します(図4)。
このため顕微鏡像では周期に伴う特有の縞模様が観察されます。コラーゲンは水に溶けにくく、低温で粘稠な透明な液で、中性で常温になると線維を形成して白いゲル状になります。
一方ゼラチンはコラーゲンを40℃以上に加熱処理し、らせん構造を壊して3本鎖をばらばらにしたものです。ゼラチンは分子量を調整することによって、ゲルの強度やゲル化温度を調節することができる水溶性の物質です。
さらにコラーゲンペプチドはゼラチンを加水分解して分子量を数千程度まで小さくしたものです。コラーゲンペプチドは酵素分解などによって分子量を小さくすることで水溶性のアップやペプチド鎖特有の生理的活性を持つ物質です。
このように、いわゆるコラーゲンと呼ばれる物質は、その状態によって物理的・化学的・生理的特徴が異なります。
参考文献
- 藤本大三郎: 未来の生物科学シリーズ32 コラーゲン, 110pp, 共立出版, 1994.
- 藤本大三郎: 科学のとびら38 コラーゲン物語, 161pp, 東京化学同人, 2006.
- 大﨑茂芳: コラーゲンの話 健康と美をまもる高分子, 中公新書, 2007.
- 服部俊治: コラーゲンの構造と応用展開, BIO INDUSTRY, 16(7), 22-33, 1999.
- 石見佳子: コラーゲンの安全性と機能性, 食品成分有効性評価及び健康影響評価プロジェクト解説集, 2004/11/04, 国立健康・栄養研究所ホームページ
