糖化应激和抗衰老
糖化应激对策 (1)血糖控制
糖化应激对策 (1)血糖控制
血糖与糖代谢的激素调节功能
在生物体内,细胞会从血液中吸收葡萄糖,用于合成作为能量来源的ATP(adenosine triphosphate)。在脑内,ATP合成依赖葡萄糖的比重较大,因此,当血糖值降低时,ATP合成会受到严重影响。因此,为了升高血糖值,防止其降低,人体内存在着胰高血糖素(glucagon)、生长激素(growth hormone)、肾上腺素(epinephrine或adrenaline)、皮质类固醇(corticosteroid)等多种激素。这些激素会通过葡萄糖转运蛋白,将葡萄糖摄取到骨骼肌和脂肪细胞中,控制细胞内的糖代谢,起到调节血糖值的作用。另一方面,可以降低血糖值的激素只有胰岛素(insulin)。一般认为,这种不平衡的机制是为了让人类对抗饥饿生存下去所做的准备(图1)(1)。
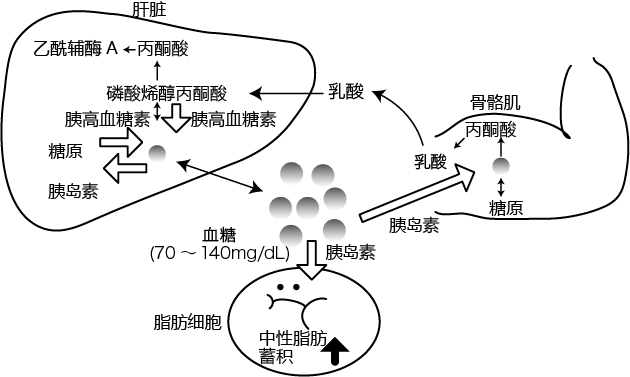
图1. 糖代谢和血糖调节机制
永井龙儿等人(2013年)(1)
健康人的血糖值在空腹时为70~90 mg/dL。但是,餐后血糖值因膳食量而异,会升高到140 mg/dL左右。血糖值的升高被大脑的下丘脑感知,由副交感神经传递到胰腺的β细胞(beta cells),促使胰岛素分泌。β细胞中存在着葡萄糖转运蛋白GLUT2(glucose transporter 2),会根据血糖值(血液中的葡萄糖浓度)将葡萄糖摄取到细胞中。随之而来的是β细胞 会感知到血糖值的升高并分泌胰岛素。另外,胰岛素在骨骼肌和脂肪细胞中可促进GLUT4(glucose transporter 4)介导的葡萄糖摄取,同时作用于糖酵解系统,促进糖代谢。这可以使因进餐而升高的血糖值降低到100 mg/dL左右。
另一方面,当下丘脑感知到血糖值降低时,胰腺的α细胞(alpha cells)会通过交感神经受到刺激,分泌胰高血糖素。在肝脏中,胰高血糖素通过磷酸化糖原磷酸化酶(glycogen phosphorylase)被激活,储存的糖原被分解为葡萄糖并分泌到血液中,血糖值升高。
伴随膳食所产生的血糖值波动,主要是依靠这一激素作用机制,在两餐之间被控制在100 mg/dL左右。
糖类的消化吸收与肠促胰岛素
膳食中含有的多糖类(糖类),会被唾液和胰液中的α-淀粉酶分解为二糖。之后,到达小肠的二糖又被具有微绒毛(microvillus)的黏膜上皮细胞刷状缘(brush border)中的α-葡萄糖苷酶(α-glucosidase)分解为单糖,进而被吸收。α-葡萄糖苷酶包括分解麦芽糖(maltose)并将其转化为2分子葡萄糖的麦芽糖酶(maltase)、将蔗糖(sucrose)分解成果糖(fructose)和葡萄糖的蔗糖酶(sucrase)、分解异麦芽糖(isomaltose)并将其转化为2分子葡萄糖的异麦芽糖酶(isomaltase)等(1)。
在生物体内,受到进餐的刺激后,小肠会分泌葡萄糖依赖性促胰岛素多肽(gastric inhibitory polypeptide:GIP)和胰高血糖素样肽-1(glucagon-like peptide-1:GLP-1)这两种激素。这些胃肠激素叫作肠促胰岛素(incretin)。此外,在连续进餐时,增多的肠促胰岛素会激活胰腺β细胞,胰岛素的分泌增加,使餐后的血糖升高受到抑制。肠促胰岛素是促进胰岛素分泌增多的胃肠道因子,其对于胰岛素分泌所起到的促进作用有助于保持餐后血糖值的稳定。
分泌GIP的K细胞(K cell)主要存在于以十二指肠、空肠为主的小肠上部。而一般认为,分泌GLP-1的L细胞(L cell)存在于小肠下部(图2)(3)。K细胞和L细胞感知到到达肠道内的营养物质后,便会各自在细胞基底膜侧分泌GIP和GLP-1。进餐后可立刻观察到GLP-1的血中浓度升高,并会维持1~2小时。GIP同样会在进餐后立刻升高,且血液中浓度的升高会维持数小时以上。糖类是促进肠促胰岛素分泌的营养物质。一般认为,糖类对肠促胰岛素分泌的促进机制是被钠依赖性葡萄糖转运蛋白1(sodium-glucose cotransporter 1:SGLT1)吸收的糖类,通过引起细胞膜的去极化,促进GLP-1和GIP的分泌。一般认为,除糖类外,蛋白质和脂质也可以促进肠促胰岛素的分泌。
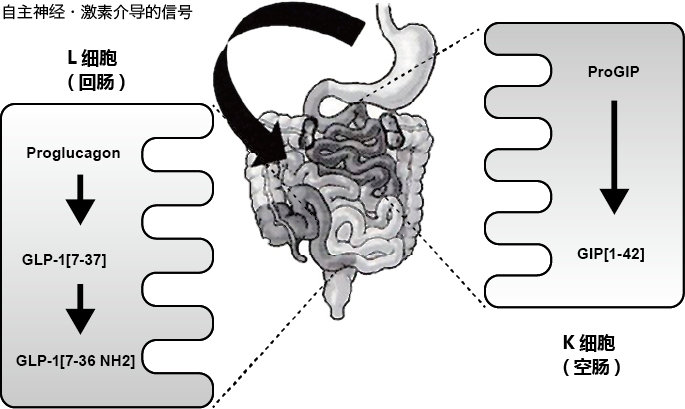
图2. 肠促胰岛素的合成分泌
大杉 満(2010年)(3)
运动与糖代谢
血液中的葡萄糖(血糖)通过GLUT4被摄取到细胞内。健康人的血糖值因进餐而升高时,胰腺会分泌相应量的胰岛素。之后,胰岛素与位于细胞表面的胰岛素受体(insulin receptor)结合,受体继而释放出将葡萄糖摄取到细胞内的信号。通过传递这一信号,细胞内部的GLUT4会出现在细胞表面,将血液中的葡萄糖摄取到细胞内。但是,若胰岛素的功能因年龄增长或糖尿病而减弱,那么胰岛素受体介导的信号就不能顺利传递,GLUT4无法出现在细胞表面,将血液中的葡萄糖摄取到细胞内的作用便会随之降低(胰岛素抵抗:insulin resistance)。GLUT4出现在细胞表面的数量也可以通过运动产生的肌肉收缩刺激而增加。此外,由于GLUT4出现在细胞表面的数量也可以通过持续运动而增加,摄取到细胞内的葡萄糖也会因此增多。由此,可保持血糖值稳定性(4)。
运动的效果分为急性效果和慢性效果。急性效果就是能量的消耗,有假说认为AMP激酶感知到骨骼肌的收缩所引发的AMP/ATP升高,通过加大糖的摄入来降低血糖值(5)。运动对糖转运的促进作用与胰岛素应答反应是不同的机制,因此,即便是具有胰岛素抵抗的患者,也可以通过运动降低血糖值。鉴于血糖值会在餐后30分钟~1小时达到最高值,在这段期间进行有氧运动,可以抑制餐后血糖值的快速升高(6)。
慢性效果则包括胰岛素敏感性增强。这一机制表明,GLUT4蛋白量的升高、运动肌肉的血流的增加、体脂肪的减少、胰岛素信号蛋白的增多等(7)。因此,运动可以抑制血糖值升高,是改善胰岛素抵抗的主要因素。
运动种类方面,一般认为步行、慢跑、游泳等有氧运动以及肌肉训练、拉伸等是有效的。
膳食与酶抑制剂
α-葡萄糖苷酶抑制剂(alpha glucosidase inhibitor:GI)是一种药物,其通过抑制将由膳食而摄入的碳水化合物分解为单糖的分解酶作用,抑制上部小肠对糖的吸收,从而抑制餐后血糖值升高。在日本,临床中使用的有阿卡波糖(acarbose,药品名称:拜唐苹)、伏格列波糖(voglibose,药品名称:倍欣)、米格列醇(miglitol,药品名称:Seibule(口崩片))这三种。阿卡波糖和伏格列波糖基本不会被肠道吸收。但是米格列醇会部分被小肠吸收,并经肾脏不变性地排泄到尿液中。阿卡波糖不仅可抑制α-葡萄糖苷酶,还有抑制α-淀粉酶的作用(图3)(2)。
食物中也存在对α-葡萄糖苷酶的抑制作用。番石榴叶多酚(对麦芽糖酶、蔗糖酶、淀粉酶有抑制作用)、小麦白蛋白(对淀粉酶有抑制作用)、L-阿拉伯糖(对蔗糖酶有抑制作用)、豆豉提取物(对α-葡萄糖苷酶有抑制作用)等都是有望对餐后血糖值升高产生抑制效果的食品原料,已经被应用到了特定保健用食品中。
肠促胰岛素是一种在进餐后由胃肠道分泌细胞分泌的,增强胰岛素分泌的激素。但是,在肠促胰岛素中,GLP-1会被存在于人体全身的dipeptidyl Peptidase-4(DPP-4)迅速降解并灭活,血浆半衰期仅为1~2分钟。因此,近年来,肠促胰岛素相关药物作为新型的糖尿病治疗用药而备受关注。在日本,被批准的药品有:利拉鲁肽(liraglutide,药品名称:诺和力)和艾塞那肽(exenatide,药品名称:百泌达、百达扬)这两个DPP-4耐药的GLP-1受体药物,以及西格列汀(sitagliptin,药品名称:捷诺维、磷酸西他列汀片)、维达列汀(vildagliptin,药品名称:天冬酰苯丙氨酸甲酯)和阿格列汀(alogliptin,药品名称:尼欣那)DPP-4抑制剂等(3)。

图3. α–葡萄糖苷酶抑制剂的作用点
藤原和哉等人(2010年)(2)
不易导致餐后血糖值升高的膳食
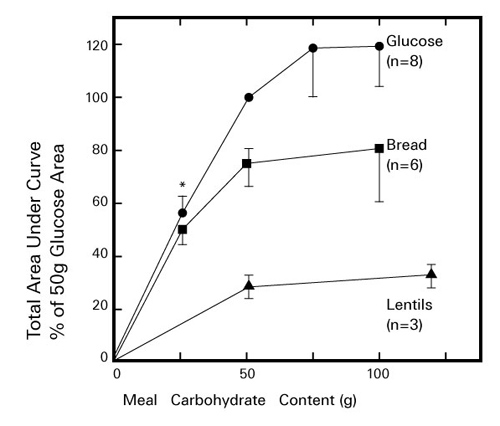
Jenkins等人在1981年观察到,即使膳食的糖类含量相同,各类以糖类为主的食物中,导致血糖值升高的速度和程度上也存在差异(图4)(8)。之后,他们对比了没有糖尿病的健康志愿者分别进食50g的62种食物后和进食等量葡萄糖后的血糖曲线下面积(area under the glucose response curve:AUC),计算并发表了食物的升糖指数(glycemic index:GI)。之后,食物的GI值便成为了临床实践中用于指导糖尿病和代谢综合征患者膳食的有效信息之一。但是,GI体现的是摄入一定糖类时,糖类的“质”对血糖值的影响,但血糖值还会受到摄入糖类的“量”的影响。因此,Salmeron等人考虑将在单次膳食中摄入的糖类的“质”和“量”作为指标,提出了升糖负荷(glycemic load: GL)(9)。GL的计算方法是,用百分比(%)来表示食物中糖类含量的比例,将这一比例乘以食物的GI,得出该值。
图4. 健康人摄入葡萄糖、全麦面包、扁豆
后的血糖值变化
一般而言,GI值在70及以上的食品属于高GI食品,56–69的属于中GI食品,55及以下的属于低GI食品。与摄入高GI食品相比,摄入低GI食品后的AUC较小,因此餐后血糖值的升高有望趋于平缓。GI值因食物的碳水化合物含量、精制程度、膳食纤维含量、脂质含量、蛋白质含量、加工程度等因素而异。另外,GI原本是一项将摄入50g碳水化合物后血糖值升高程度,与等量葡萄糖作为标准食品并设为100时的相对值来表示的指标。但是,以GI值的形式表示的信息中需要注意的是,参考饮食的食品种类(米饭、面包等)或糖类含量可能不同。在日本,日本Glycemic Index研究会(日本GI研究会)推荐执行以147g袋装大米(相当于50g糖类)为参考饮食的规定(统一方法)(10)。
此外,还可通过在食品中添加膳食纤维来使餐后血糖值的上升趋于平缓。水溶性膳食纤维难消化糊精,在与碳水化合物或单糖类一同摄入时,会发生水溶胀,减慢从胃排入肠的速度,并在小肠中转变为有粘性的凝胶状,阻碍食物扩散,令分解酶难以接触到食物,延缓糖类的消化吸收,从而抑制餐后血糖值的升高。混合了难消化糊精的食品有望具有控制餐后血糖值升高的效果,并作为具有该效果的食品原料,应用于特定保健食品等中(11)。
此外,餐后血糖值的升高水平也会因进食时食物的摄入顺序而变化。报告显示,在同时食用200g米饭和60g蔬菜(沙拉)时,先食用蔬菜后食用米饭时,血糖值升高和胰岛素分泌更为平缓(12)。在这项结果发表之后,基于进食顺序的健康管理方法受到关注(13)。另有报告显示,无论采用何种进食顺序,如果在乌冬面或米饭上添加蔬菜、温泉蛋等配菜同时食用,也可抑制餐后血糖值的升高(图5)(14)。
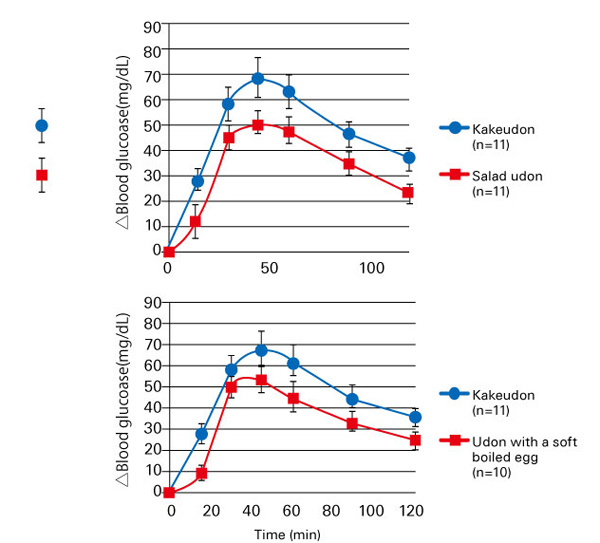
图5. 在乌冬面中添加沙拉或温泉蛋食用时的餐后血糖值变化
碳水化合物与血糖值升高有关,因此,近年来,减少其摄入量的减糖饮食成为了热门话题。但要注意的是,碳水化合物也是一种重要的营养物质,已有研究结果指出,极度控制糖类摄入会增加死亡风险(15)。
References
-
- 永井竜児ら:基礎生化学 健康・疾病とのつながり. 2013, アイケイコーポレーション (東京).
- 藤原和哉ら:糖尿病の最新治療. 2010;2:6-15.
- 大杉 満:糖尿病の最新治療. 2010;2:21-26.
- 春日雅人:第116回医学会シンポジウム記録集 生活習慣と糖尿病の発症. 2000;13-18.
- Winder WW, et al.:Am J. Physiol. 1999;277:E1-E10.
- Derave W, et al.:Obesity. 2007;15:704-711.
- Chibalin AV, et al.:Pro Natl Acad Sci. 2000;97:38-43.
- Jenkins DJA, et al.:Am J Clin Nutr. 1981:362-366.
- Salmeron J, et al.:JAMA. 1997 ; 277:472-477.
- 日本Glycemic Index 研究会:http://www.gikenkyukai.com/protocol.html.
- 河合博成ら:健康・栄養食品研究. 2002;5:33-45.
- 金本郁男ら:糖尿病. 2010;53:96-101.
- 梶山静夫ら:なぜ、「食べる順番」が人をここまで健康にするのか:この食べ方で高血圧、糖尿病、高脂血症にならない! 2012, 三笠書房(東京).
- Matsushima M, et al.:Glycative Stress Research. 2014;1:53-59.
- Noto H, et al.:PLoS ONE 8(1):e55030. doi:10.1371 / journal.pone.0055030
糖化应激和抗衰老
- 什么是糖化应激?
- 糖化应激标志物的检测方法(1) 血糖、糖化蛋白、糖化反应中间体的检测
- 糖化应激标志物的检测方法(2) AGEs的检测
- 糖化应激标志物的检测方法(3) 抗糖化作用评价
- 糖化应激和AGEs受体
- 糖化应激与肾疾病
- 糖化应激和皮肤老化
- 糖化应激与动脉硬化
- 糖化应激和精神分裂症
- 糖化应激与肝病
- 糖化应激与不孕症
- 糖化应激与阿尔兹海默症
- 糖化应激对策(1) 血糖控制
- 糖化应激对策(2) 糖化反应的抑制
- 糖化应激对策(3) AGEs的降解和排泄
- 糖化应激对策(4) 膳食来源的AGEs
- 糖化应激对策的课题和展望