糖化应激和抗衰老
糖化应激对策 (3) AGEs的降解和排泄
糖化应激对策 (3) AGEs的降解和排泄
在肾脏中的AGEs排泄
通过蛋白质代谢游离到血液中的AGEs和进食后被肠道吸收的AGEs会被肾脏排泄到尿中。肾脏的近端小管中存在一种叫作巨蛋白(megalin)的膜受体,可以重吸收从尿中滤过的低分子量蛋白。血液中的AGEs在肾脏中与巨蛋白结合后,会通过细胞摄取细胞外物质的作用,也就是内吞作用(endocytosis),摄取到肾小管细胞中(图1)(1)。但是,当大量AGEs被摄取到巨蛋白中时,在一种细胞内细胞器--溶酶体(lysosome)中的AGEs降解将达到饱和,AGEs会在肾小管细胞中蓄积(2-3)。从而导致肾功能下降,AGEs在体内的蓄积增多。
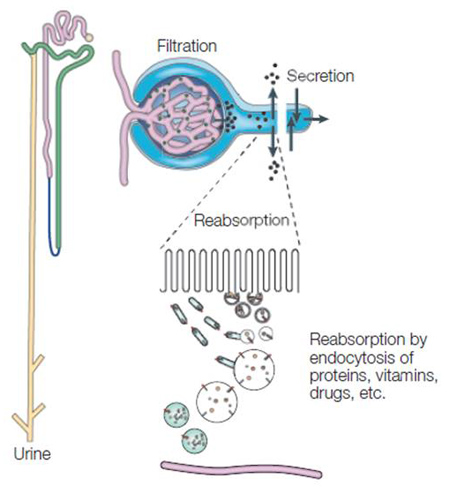
图1.肾脏的蛋白质代谢排泄作用(改编自Christensen et al.(1))
糖化/氧化应激引起的蛋白质修饰和代谢
随着年龄增长,神经系统、免疫系统、内分泌系统的功能,以及其他各种细胞、组织的功能会下降,蛋白质异常在其中起着重要作用。在生物体内,糖化应激和氧化应激会导致蛋白质发生化学修饰,从而出现异常。这种蛋白质叫作异常蛋白(altered proteins),其在生物体内的功能会降低,而且会破坏细胞和组织(4)。蓄积在阿尔茨海默病(Alzheimer disease)患者大脑中的β-淀粉样蛋白(β-amyloid)是一种异常蛋白,会损伤神经细胞,使记忆和学习功能等神经功能降低。眼球晶状体中的晶状体蛋白(crystalline)也会随着年龄增长而变性,因凝聚(异常蛋白化)而变得混浊,导致白内障。此外,帕金森病(Parkinson’s disease)等许多神经退行性疾病都是由于结构改变的异常蛋白的蓄积而引起的(5)。
通常,异常蛋白会被称为蛋白酶体(proteasome)的蛋白水解酶降解。蛋白酶体有2种,分别是26S(分子量250万)和20S(分子量70万)。多数异常蛋白在经过泛素化之后,会被26S蛋白酶体降解。而氧化蛋白也会被20S蛋白酶体降解(图2)(5)。但是,AGEs化的蛋白质则由于蛋白交联的形成所引发的硬化变性等,很难被蛋白酶降解(6)。
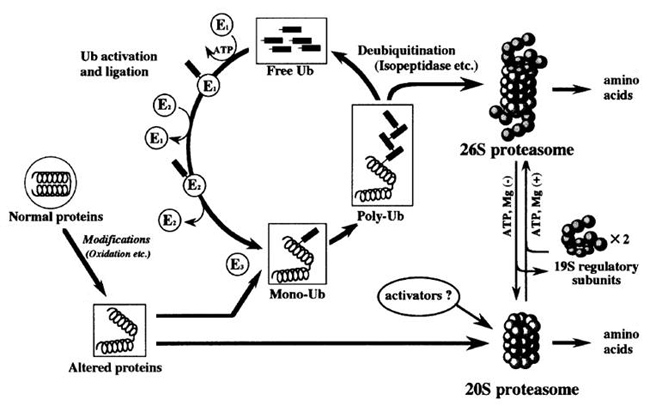
图2.蛋白酶体的泛素化蛋白降解作用(Goto S, et al.(2001)(4))
生物体会通过重复进行蛋白质的合成和降解,不断清除细胞中产生的异常蛋白,并重新利用降解产生的氨基酸,由此来维持功能。但对于老龄动物而言,细胞的蛋白质合成能力会随年龄增长而降低,导致代谢周转变慢。而且,细胞蛋白会因年龄增长带来的AGEs化而变得难以降解,体内的异常蛋白量增加。
对AGEs交联有降解作用的物质
N-phenacylthiazolium bromide(PTB)对蛋白质的AGEs化所产生的交联(AGEs-derived crosslink)有分解作用,并作为具有该作用的物质而广为人知(7)。PTB可以识别出糖化应激所产生的来源于Amadori蛋白的蛋白质交联物质(amadori-protein-ene-dion-derived)的α-二酮结构并破坏C−C键,降解蛋白质-蛋白质交联(protein-protein crosslink)(图3)(7)。这表明,该作用可能有助于抑制AGEs在血管中的蓄积、治疗糖尿病血管并发症等。连续4周以10 mg/kg的剂量对糖尿病大鼠经口给予PTB的试验结果显示,PTB对抑制胶原蛋白的AGEs交联形成(7)和降解血管中的AGEs起到了作用(8)。对糖尿病大鼠给予提高了PTB水溶性的3-phenacyl-4,5-dimethylthiazorium chloride(ALT-711)的试验也显示,PTB对抑制血管的硬化和AGEs蓄积起到了作用(9)。在一项人体的临床试验中,以210 mg/day或420 mg/day的剂量口服摄入8周ALT-711,ALT-711对血管僵硬(vascular stiffening)和收缩压控制不良(uncontrolled systolic blood pressure)具有改善效果(10-11)。因为这些结果,PTB被冠以了“AGEs降解剂(AGE breaker)”之称。
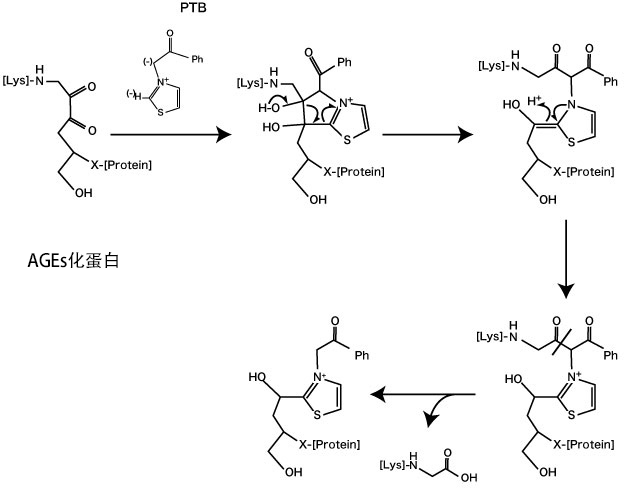
图3. N-phenacylthiazolium bromide (PTB)的AGEs交联降解作用(Vasan S, et al.(1996)(7)
但是,有报告称,PTB对于糖尿病大鼠的皮肤和尾部胶原蛋白的AGEs交联降解无效(12),也有对PTB的作用表示怀疑的见解。
已知与PTB具有相同作用的植物成分有五月艾(Artemisia indica)、线状阿司巴拉妥(Aspalathus linearis)、紫云英(Astragalus sinicus)(13)、香橙(Citrus junos)(14)、石榴(Punica granatum)(15)提取物。
YAC提取物作为五月艾的乙醇提取物,可以降解胶原蛋白凝胶-葡萄糖反应系统模型中生成的AGEs交联(AGE-crosslink)。此外,连续6个月使用含有YAC提取物的化妆水、乳液、乳霜的试验结果表明,该物质对皮肤弹性和肌肤泛黄(b*)起到了改善作用(13)。
有研究表明,terpinen-4-ol作为香橙(Citrus junos)中含有的一种单萜醇(monoterpene alcohols),在与氢过氧化物(hydroperoxide)进行亲核取代反应(nucleophilic substitution)后,经拜耳-维立格氧化(Baeyer-Villiger oxidation)重排反应生成羧酸酯(carboxylate ester),使酸酐(acid anhydride)水解,对AGEs交联的降解起到了作用(14)。
根据推测,石榴汁提取物及石榴来源成分的AGEs交联降解作用,可能与鞣花单宁的三羟基苯(trihydroxybenzene)结构有关(15)。
这些天然产物的AGEs交联降解作用,可能有助于对已经蓄积在体内的AGEs进行降解排泄。
氧化蛋白水解酶的AGE降解作用(13)
氧化蛋白水解酶(oxidized protein hydrolase:OPH)是一种丝氨酸蛋白酶(serine protease),广泛存在于猪肝、人血、大鼠大脑等生物体组织中(图4)(16-17)。有报告显示,在人的皮肤中,OPH存在于角质层(18-19)。 OPH是释放蛋白质N末端酰化氨基酸的酶,因此也作为酰基氨基酸释放酶(acylamino-acid releasing enzyme:AARE)而被熟知。 OPH除了作用于acyl化,还对formyl化、acetyl化、butyl化、propyl化的蛋白质的N末端氨基酸(20),以及受到了氧化和糖化修饰的老化蛋白有降解作用(21)。而且,OPH和蛋白酶体协同作用于老化蛋白的降解(22)。在糖尿病大鼠体内,血清OPH活性显著升高,血中羰基修饰蛋白量降低(23)。
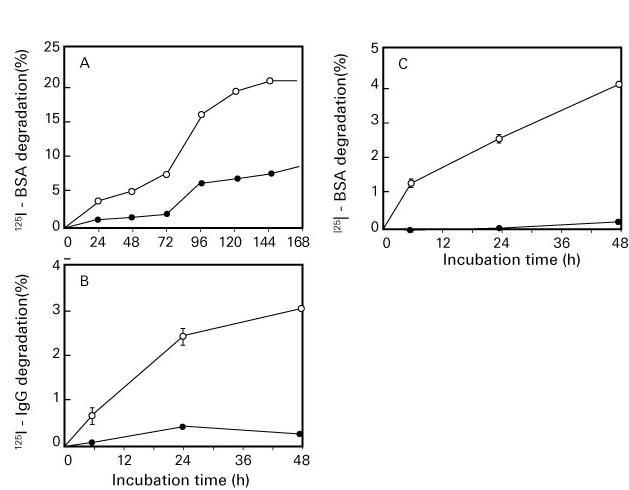
图4.氧化蛋白水解酶(OPH)的氧化/糖化蛋白降解作用(Fujino T, et al.(21))
A:氧化牛血清白蛋白(BSA), B:氧化免疫球蛋白G(IgG), C:糖化BSA
●:未处理(对照), ○:氧化或糖化蛋白
已知影响OPH活性的天然产物有茶叶、药草、蔬菜等植物的提取物。有的药草类和健康茶会促进OPH活性。而来源于茶树的茶叶和儿茶素类则会抑制OPH活性(24-26)。 OPH具有降解广泛存在于生物体组织中的糖化蛋白和AGEs的作用。因此,天然产物的OPH激活作用可能有助于促进体内AGEs的降解排泄。
References
-
- Christensen E, et al.:Nat Rev Mol Cell Biol. 2002; 3: 256-266.
- Miyata T, et al.:Kidny Int, 1998 ; 53 : 416-422.
- Gugliucci A, et al.:Diabetologia, 1996 ; 39 : 149-160.
- Goto S, et al.:Ann N Y Acad Sci. 2001; 928: 54-64.
- Carrard G, et al.:Int J Biochem Cell Biol. 2002; 34: 1461-1474.
- Schnider, et al.:J Clin Invest. 1981; 67: 1630-1635.
- Vasan S, et al.:Nature. 1996; 382: 275-278.
- Cooper ME, et al.:Diabetologia. 2000; 43: 660-664.
- Freidja ML, et al.:Cardiovascular Diabetology 2014; 13: 55-71.
- Bakris GL, et al.:Am J Hypertens. 2004; 17: 23S-30S.
- Kass DA, et al.:Circulation. 2001; 104: 1464-1470.
- Yang S, et al.:Arch Biochem Biophys. 2003; 412: 42-46.
- 多田明弘:COSMETIC STAGE. 2011; 5: 33-38.
- Nagamatsu R, et al.:Biosci Biotechnol Biochem. 2012; 76: 1904-1908.
- Yagi M, et al.:Glycative Stress Research. 2015; 2: 58-66.
- Mitta M, et al.:J Biochem. 1998; 123: 924-931.
- Fujino T, et al.:J Biochem. 2000; 127: 1081-1086.
- 石神政道ら:第14回日本抗加齢医学会総会プログラム抄録集. 2014: 349.
- 石神政道ら:第15回日本抗加齢医学会総会プログラム抄録集. 2015: 239.
- Krishna RG, et al.:Protein Science. 1992; I: 582-589.
- Fijino T, et al.:J Biochem. 1998; 124: 1077-1085.
- Shimizu K, et al.:Biochemi Biophys Res Commun. 2004; 324: 140–146.
- Shimizu K, et al.:Biol Pharm Bull. 2009; 32: 1632-1635.
- 八木雅之ら:第13回日本抗加齢医学会総会プログラム抄録集. 2013: 253.
- 三橋璃子ら:第13回日本抗加齢医学会総会プログラム抄録集. 2013: 254.
- 三橋璃子ら:第14回日本抗加齢医学会総会プログラム抄録集. 2014: 362.
糖化应激和抗衰老
- 什么是糖化应激?
- 糖化应激标志物的检测方法(1) 血糖、糖化蛋白、糖化反应中间体的检测
- 糖化应激标志物的检测方法(2) AGEs的检测
- 糖化应激标志物的检测方法(3) 抗糖化作用评价
- 糖化应激和AGEs受体
- 糖化应激与肾疾病
- 糖化应激和皮肤老化
- 糖化应激与动脉硬化
- 糖化应激和精神分裂症
- 糖化应激与肝病
- 糖化应激与不孕症
- 糖化应激与阿尔兹海默症
- 糖化应激对策(1) 血糖控制
- 糖化应激对策(2) 糖化反应的抑制
- 糖化应激对策(3) AGEs的降解和排泄
- 糖化应激对策(4) 膳食来源的AGEs
- 糖化应激对策的课题和展望