学術情報
糖化と骨疾患
糖化と骨疾患、アルツハイマー病
骨の構造と機能
成人では、206本の骨が骨格筋や靭帯でつながれ、骨格を形成しています。
骨は骨膜、骨質、骨髄および関節軟骨の4つで構成されています。
骨膜は関節面以外のすべての骨の表面を覆っている薄い膜で、主にコラーゲン繊維からできており、骨表面の保護、神経伝達、骨を生成する役割を果たしています。
骨質は骨組織からなり、骨表面の緻密質(骨皮質)と内部の海綿質(骨基質)に分けられます(図1)。緻密質は骨本体の白く硬い部分で、骨質の維持、管理をしています。海綿質はコラーゲン繊維と、リン酸カルシウムを主成分とする繊維質(ハイドロキシアパタイト)からできています。
骨髄は骨の内腔(髄腔)に存在し、多量の血液を作っているため赤く見えます(赤色骨髄)。
軟骨は軟骨細胞と軟骨基質から構成されており、基質の成分と硬さの違いによりガラス軟骨、繊維軟骨、弾性軟骨に分類されます。
骨には、体を支える、血液を作る、臓器を守る、カルシウムを貯蔵する、骨代謝を行うなどの働きがあります。
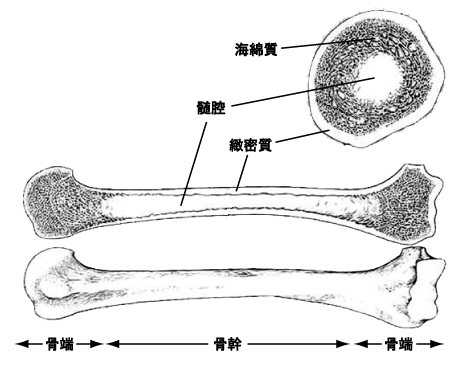
図1. 骨の構造
(船戸, Terminologia Anatomica(1998)に基づく解剖学より)
骨代謝とAGEs
骨では、破骨細胞によって古い骨が壊され(骨吸収)、骨芽細胞によって新しい骨が作られる(骨形成)という、骨代謝が常に行われています。骨吸収と骨形成のバランスがうまく保たれる事で、骨は常に良い状態に保たれます。
マウスの骨芽細胞にはAGEs受容体が存在し、特に成熟した骨芽細胞ではRAGEの高発現が見られています。またAGEs化したⅠ型コラーゲンは骨芽細胞へのミネラル沈着を阻害し、生存細胞数を減少させ、骨形成過程に悪影響を及ぼすことが確認されています。さらに破骨細胞では、AGEsが骨吸収を促進することが知られています。
また骨基質成分中の90%以上を占めるコラーゲンのAGE化は骨の剛性を増加させ、外部から骨へ伝わる応力の吸収を低下させるため、骨障害の原因になっています。このようにAGEsの骨組織への蓄積は骨代謝のバランスを崩し、物理的な強度を低下させて骨を脆弱化するとされています。
糖尿病における骨代謝異常に関与する因子は、インスリンの作用不足、高血糖状態、そして動脈硬化、神経障害、腎障害などの合併症があります。
インスリンの作用低下は、骨芽細胞と共に破骨細胞の形成を抑制して骨粗鬆症を招きます。同時に活性型ビタミンDの合成低下を引き起こし、腸管や腎からのCa再吸収の低下により負のCaバランスをもたらします。
また持続的な高血糖状態は、副甲状腺からのPTH分泌を低下させ、骨芽細胞分化や機能不全により骨代謝を低下させます。さらに高血糖は骨におけるAGE形成・蓄積を亢進し、骨コラーゲンの分子間にAGEによる架橋を形成させてコラーゲン線維の硬化・脆弱化します。
糖尿病に伴う合併症の進展では、細小血管障害に伴う骨への血流量減少が骨細胞の機能低下をもたらし、神経障害や下肢閉塞性動脈硬化症による下肢の血流低下や機能低下、筋力低下が骨減少症進行の増悪因子となっています。また糖尿病性胃腸障害による消化吸収障害からの栄養不良も骨減少の促進因子になっています(図2)。
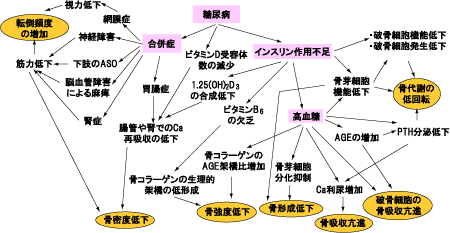
図2. 糖尿病における骨代謝異常発生機序
(久米田,骨粗鬆症治療 6(2), 2007(先端医学社)より)
骨疾患とAGEs
骨の疾患には、骨髄炎、化膿性関節炎、変形性関節症、骨粗鬆症、骨肉腫、椎間板ヘルニア、慢性関節リウマチ、痛風などさまざまな病気があります。中でも骨粗鬆症、変形性骨関節症、慢性骨関節リウマチなどは糖化反応の進展に関係が深いと考えられています。
かつて骨粗鬆症(osteoporosis)は「骨量の減少と骨の微細構造の破綻によって骨折に対する感受性が高まった全身的骨格疾患」とされてきました。しかし2000年にNIH(米国国立公衆衛生研究所)で開催されたコンセンサス会議において、骨粗鬆症とは「骨折リスクを増すような骨強度上の問題(compromized bone strength)をすでにもっている人に起こる骨格の疾患」であると定義され、「骨強度=骨密度+骨質」と明記されました。
近年、骨粗鬆症や糖尿病における骨の脆弱化には、骨中コラーゲンの架橋異常が関与していることが明らかになってきました。
コラーゲンは骨の体積あたり50%を占める主要な線維タンパクで、α鎖3本から成る3重らせん構造をとっています。細胞外に分泌されたコラーゲン分子は、規則正しく配列する際に、隣り合う分子間や分子内に架橋結合を形成します。架橋結合はコラーゲンの線維強度に関与し、機能や形成メカニズムの違いにより2つに大別されます。
一方はリジルオキシダーゼ(lysyl oxidase:LOX)を介して秩序立って形成される生理的架橋「善玉架橋」であり、もう一つは非酵素的な糖化・酸化反応によって形成されたAGEsにより、コラーゲン分子間をランダムに架橋する非生理的架橋「悪玉架橋」です(図3)。善玉架橋はコラーゲン線維の適度な弾性獲得に寄与します。しかし悪玉架橋は過度に架橋することによってコラーゲン線維を脆弱化します。
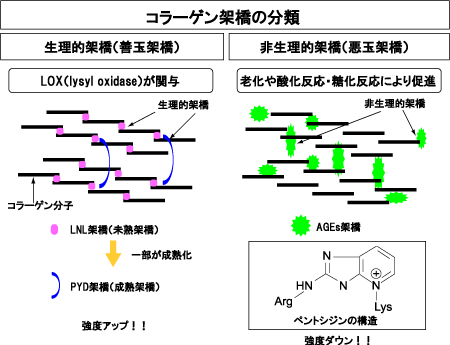
図3. 骨コラーゲン架橋とその分類
(前田ら,骨粗鬆症治療 7(1), 2008(先端医学社)より)
この原因としては生活習慣病リスクとして知られる血中ホモシステインの高値化やビタミンB6の低値化および酸化ストレスの増大が考えられています(図4)。
変形性骨関節症(osteoarthrosis:OA)は高齢者の整形外科疾患の中で最も一般的であり、60歳以上の1/4に関節の痛み、運動制限、関節液貯留などの症状として現れます。これらの多くは、加齢、肥満、性ホルモン、血行などが関与すると考えられています。
関節の軟骨は軟骨細胞と、主としてコラーゲンとプロテオグリカンからなる軟骨基質で構成されています。OAの初期変化はプロテオグリカンの重合度低下や軟骨自体の粘弾性・耐摩擦性低下として現れます。
軟骨には他の組織と比べて、加齢に伴うペントシジンやCMLなどのAGEs蓄積が多いことが知られ、このAGEsがプロテオグリカンの生成を抑制するとともに、マトリックスメタロプロテアーゼを介した軟骨分解に作用していると推定されています。またOA患者では、健常者と比べて軟骨細胞でAGE受容体の1つであるガレクチン3の発現が多いため、軟骨細胞機能に悪影響を与えていることも推定されています。さらに糖尿病患者のAGEs蓄積レベルとOAの罹患率や重症度には相関がみられています。
慢性関節リウマチ(rheumatoid arthritis:RA)は関節の炎症性疾患で、IgGに対するIgMクラスの自己抗体(リウマトイド因子)に代表される自己免疫疾患です。RA患者の血中や関節液中にはペントシジンが増加しており、AGEs化IgGに対する自己抗体の産生が指摘されています。
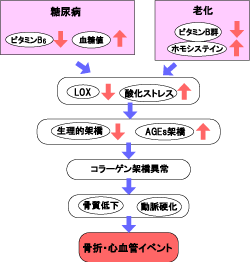
図4. 生活習慣病のリスク因子とコラーゲン架橋異常
(前田ら,骨粗鬆症異常 7(1), 2008(先端医学社)より)
アルツハイマー病とAGEs
アルツハイマー病(Alzheimer’s disease:AD)は、脳を構成している神経細胞が通常の老化よりも急速に減ってしまうこと(変性)によって、正常な働きを徐々に失っていき、認知症(痴呆)になっていく病気です。原因はまだわかっていませんが、遺伝的な要因に加えて生活環境の影響が重なり、発病すると考えられています。
ADの特徴的な病理構造物はアミロイドβ蛋白(amyloid β protein:Aβ)で構成された老人斑です。Aβは40個のアミノ酸からできており16と28番目のアミノ酸が糖化されると推定されています。またAD患者脳の前頭葉から得たタンパク分画には、健常老人と比べて3倍のAGEsを含むことが報告されています。現在、AβのAGE化は2次的な修飾として起こるという考え方が主流ですが、糖化によるタンパク質間の架橋がAβの凝集・沈着を促進・加速する因子として関与しているとも考えられています。
ADにおいて老人斑とならぶ重要な病理構造物に、神経原線維変化(neurofibrillary tangles:NFT)があります。NFTは電子顕微鏡観察的にPHF(paired helical filaments)とよばれる特異な線維の束で、タウ(微小管結合タンパク質の一種:tau protein)を主成分としています。
タウは脳の神経細胞に蓄積し、その細胞を破壊するアルツハイマー病の原因物質であるといわれています。AD患者脳から抽出されたPHFタウは糖化されているけれども、可溶性タウまたは非痴呆者脳のタウは糖化されていないことが報告されています。また糖化されたPHFタウは、アミロイド前駆蛋白(amyloid precursor protein:APP)とAβの生成を誘導し、これらの細胞内蓄積を増加させます。タウの糖化によって、タウの沈着促進と共にAPPの蓄積によるAβの生成がADの病態に関与していると考えられています。
また培養ラット海馬ニューロンに各種AGEsを添加し、アポトーシスの発生を調べた実験では、AGEsが神経毒性を有することを示しています。これらの神経毒性はグリア細胞(神経系を構成する神経細胞ではない細胞の総称:glial cell)にあるAGEs受容体(RAGE)を介して生じたと推定されています。さらにAβのAGE化によって活性酸素、NO、炎症性サイトカイン(IL-1、IL-6、TNF-α)の産生が神経毒性を増強しているとも考えられています。
以上のようにAβの糖化抑制は、老人斑の抑制、糖化・リン酸化タウの凝集抑制によるNFT形成の抑制、AGEs自体の産生抑制が神経細胞死の進行を抑制し、アルツハイマー病の病態改善に作用する可能性があると考えられています(図5)。
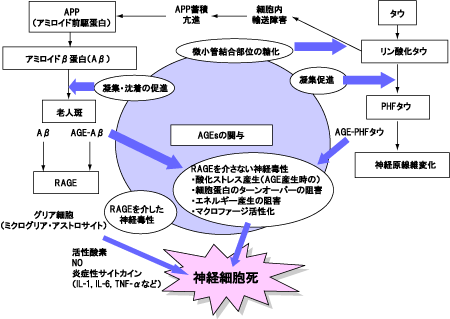
図5. AGEsのアルツハイマー病の病態への関与
(佐々木,AGEs研究の最前線(メディカルレビュー社)より)
参考文献
-
- 山岸昌一(編), AGEs研究の最前線 糖化蛋白関連疾患研究の現状, 231pp, メディカルレビュー社, 2004.
- 船戸和弥, Terminologia Anatomica(1998)に基づく解剖学
http://web.sc.itc.keio.ac.jp/~funatoka/anatomy.html - 久米田晴郎, 骨粗鬆症治療6(2), 104, 先端医学社, 2007.
- 前田和洋, 骨粗鬆症治療7(1), 2, 先端医学社, 2008.
糖化と抗糖化 詳細目次
- 生体内糖化反応とAGEs
- 生体中糖化反応のモニタリング
- AGEsとポリオール代謝経路
- 糖化と糖尿病合併症
- 糖化と動脈硬化
- 糖化と骨疾患、アルツハイマー病
- 糖化と皮膚老化
- 糖化反応阻害剤(合成化合物、既存医薬品)
- 糖化反応阻害剤(ビタミン類、その他の物質)
- 天然物中の糖化反応阻害成分
- アンチエイジングと抗糖化
– 学術術情報一覧
