学術情報
生体内糖化反応とAGEs
生体内糖化反応とAGEs
糖化反応とは
糖化反応(glycation)は1912年にLC Maillardがアミノ酸と還元糖を加熱すると褐色の色素が生成することを発見したことから、メイラード反応として知られるようになった(図1)。発見以来、糖化反応は食品の加熱中に起こる着色や、香り・風味の変化、保存期間中の栄養価低下に関わる反応であることから食品化学の領域で注目されてきた。

図1. 糖化反応のモデル実験
1.0mol/Lのアミノ酸水溶液に、0~1.0mol/Lになるようにグルコースを添加して、加熱処理した(95℃, 3hr)
1960年代になると、生体反応としてタンパク質糖化反応が注目されるようになり、その代表的な生成物としてヘモグロビンA1c(HbA1c)が血糖コントロール指標として糖尿病治療領域で臨床応用されるようになった。また糖尿病では様々なタンパク質糖化反応生成物が合併症の進展に関与していることが明らかになり、病態生理の解明・予防・治療への研究が展開されている。
さらに近年、糖化反応は老化現象、認知症、癌、高血圧、動脈硬化症などにも関与していることが明らかになり、食品、糖尿病以外の新たな分野でも研究展開されている。
生体内糖化反応系とAGEs
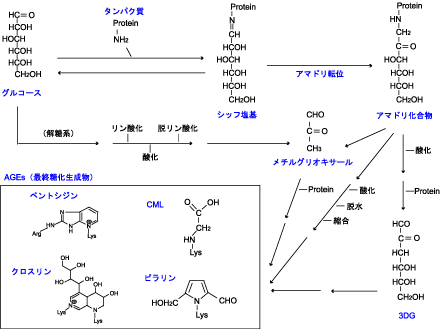
図2. 生体内における主な糖化反応経路
糖化反応経路は未解明な部分が多く代表的な経路を示した
糖化反応(メイラード反応)はアミノ基とカルボニル基の間の非酵素的な化学反応で、アミノカルボニル反応とも呼ばれる(図2)。グルコースなど還元糖のカルボニル基(C=O)がタンパク質やアミノ酸のアミノ基(NH2)と反応すると、シッフ塩基(C=N:アルジミンとも呼ばれる)を形成する。本段階は可逆的な反応であるが、引き続きエナミノールを経て、アマドリ転位によって安定なアマドリ化合物(C-N:ケトアミンとも呼ばれる)になる。生体中のアマドリ化合物としてはHbA1cやグリコアルブミンなどが代表的な物質である。
糖化反応系はアマドリ化合物生成までの反応を初期段階(early stage)と呼び、以降の後期段階(advanced stage)反応と区別されている。
アマドリ化合物は、脱水、加水分解、炭素間の開裂により、グリオキサール(GO)、メチルグリオキサール(MG)、3-デオキシグルコソン(3DG)など、分子内に2つのカルボニル基(C=O)を有するα-ジカルボニル化合物を生成する。特に3DGとMGはグルコースの10,000倍の反応性を有する。このため糖化反応系におけるこれらの生成は、未反応のアミノ酸残基に作用して糖化反応を急速に進行させる。
その後、生体内ではα-ジカルボニル化合物、シッフ塩基やアマドリ化合物の分解、脂質過酸化反応由来のアルデヒド、糖の自動酸化や分解などによりAGEs(advanced glycation endprpducts:糖化最終産物)が生成する。AGEsという名称は、あくまでも糖化反応による生成物の総称であり、一定の構造を示す化合物ではない。AGEsにはin vitroで生成するものを含め、現在まで様々な構造物質が解明されている(図3)。
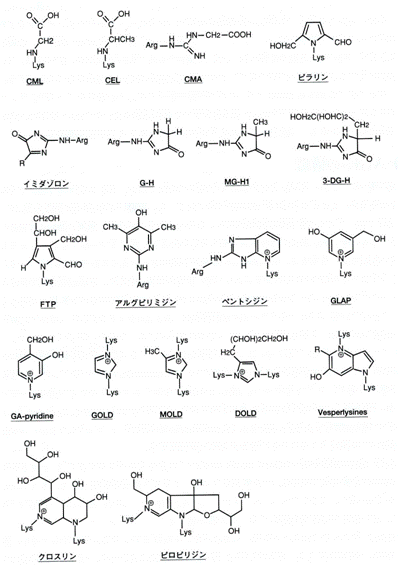
図3. 主なAGEs構造体
R側鎖の構造は糖の種類によって異なる
(渡辺と早瀬,AGEs研究の最前線(メディカルレビュー社)より)
そのうち比較的よく研究されているAGEsにはCML(Nε-(carboxymethyl)lysine)、ペントシジン(pentosidine)、ピラリン(pyrraline)、クロスリン(crossline)などがある。
CMLはアマドリ化合物の酸化開裂および脂質の過酸化反応由来のGO、あるいは次亜塩素酸とセリンから生じるグリコールアルデヒドとリジン残基の反応により生成する。また、ヒドロキシラジカル(・OH)やパーオキシナイトライト(ONOO・)などの活性酸素種の存在により生成が促進される。類似のCEL(Nε-(carboxyethyl)lysine)は、MGがリジン残基と反応して生成したものである。
ペントシジンは、リジンとアルギニン残基をペントースが架橋した構造で、アミノ酸とリボース、キシロース、アラビノースなどにより生成する。またグルコース、フルクトースなどのヘキソースや3DGからも低率であるが生成することが知られている。
ピラリンは3DGとリジン残基の反応により生成する。クロスリンは2つのリジン残基とグルコースが架橋した構造である。
AGEsの物理化学的な特徴としては、黄褐色で蛍光(主に、Ex: 370nm、Em: 440nm)を持ち、タンパク質間に架橋を形成することがある。しかし、ピラリンのように蛍光性を示さず、架橋構造を有しないAGEsも確認されている。また、CMLやペントシジンの生成過程のように、糖化反応と酸化反応が関与する場合には、グリコキシデーション(glycoxidation)と呼ぶこともある。さらに類似化合物として、マロンジアルデヒド(malondialdehyde)など、脂質酸化反応由来アルデヒド生成物もいくつか報告されており、これらはALEs(advanced lipooxidation endproducts)と呼ばれている。
生体内AGE受容体
AGEsの生物学的特徴として、AGE化したタンパク質(AGE修飾タンパク)をリガンドとして認識するAGE受容体の存在が知られている。細胞はAGE修飾タンパクとAGE受容体の結合を引き金にして、サイトカインや成長因子の産生亢進など種々の細胞応答を引き起こし、糖尿病血管合併症をはじめとする種々の疾患発症・進展へと向かうことが考えられている。現在、AGE受容体としては、ガレクチン3(galectin-3)、RAGE(receptor for AGEs)、SR-A、CD36、SR-BI、LOX-1、FEEL-1およびFEEL-2の7つが知られている(図4)。
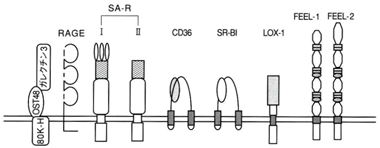
図4. AGE受容体の種類
SR-A, CD36, SR-BI, LOX-1はスカベンジャー受容体ファミリーに属する
(高木ら,AGEs研究の最前線(メディカルレビュー社)より)
1990年代以降、抗AGE抗体を用いた免疫学的研究によって、AGE修飾タンパクが糖尿病性血管合併症、動脈硬化、アルツハイマー病など、多くの疾患病変部に沈着していることが確認された。これら病変部でのAGEs蓄積が、その病気の直接因子なのか、単に病態の結果を反映しているのかは今もなお明確になっていないが、多くの研究がAGE受容体との反応が病変の発症・進展に必須な役割を果たしているという視点から展開している。
AGE受容体に関する研究では、病変部における病態発症へと導く詳細なメカニズムや、生体内AGEsをトラップして無毒化するメカニズムなど、未解明な課題があり今後の機能解析が期待される。
参考文献
-
- 繁田幸雄ら(編), 蛋白の糖化 AGEの基礎と臨床, 163pp, 医学書院, 1997.
- 山岸昌一(編), AGEs研究の最前線 糖化蛋白関連疾患研究の現状, 231pp, メディカルレビュー社, 2004.
糖化と抗糖化 詳細目次
- 生体内糖化反応とAGEs
- 生体中糖化反応のモニタリング
- AGEsとポリオール代謝経路
- 糖化と糖尿病合併症
- 糖化と動脈硬化
- 糖化と骨疾患、アルツハイマー病
- 糖化と皮膚老化
- 糖化反応阻害剤(合成化合物、既存医薬品)
- 糖化反応阻害剤(ビタミン類、その他の物質)
- 天然物中の糖化反応阻害成分
- アンチエイジングと抗糖化
– 学術術情報一覧
