学術情報
アンチエイジングと抗糖化
アンチエイジングと抗糖化
いつまでも若々しく過ごし続けることは、誰もが持っている永遠の願いです。これまで老化は自然現象として仕方がないものと考えられてきました。しかし近年、医学の進歩により老化のメカニズムが解明されはじめ「抗加齢医学(アンチエイジング医学)」とよばれる、老化のプロセスそのものをひとつの病気と捉え、その原因を克服することで老化を治療することを目的とした医学体系ができてきました。アンチエイジングとは加齢による老化の進行を穏やかにし、それぞれの年齢において心と身体がバランス良く、最もイキイキとした状態に保ち続けることを意味しています。
現在提唱されている老化の主な原因は、次の6つがあります。
- プログラム説
- エラー説
- クロスリンキング説
- フリーラジカル説
- 自己免疫説
- 代謝調節説
また近年、活性酸素種の生成、カルボニルストレスにおける糖化反応、TAGE(toxic-AGE)、タンパク質の代謝回転遅延は老化進展要因として注目されています。さらに抗糖化(糖化抑制)は体のタンパク質の変性防止になることから、老化予防に繋がると考えられています。
以下に、老化を進展させる要因とその対策、および糖化が関与する老化進展メカニズムを解説します。
活性酸素種(ROS)
生物が呼吸して取り入れている酸素の95%以上は生体中ミトコンドリア内の電子伝達系で水に分解されます。またミクロソームの電子伝達系では水酸化反応により水酸化されますが、その3~5%が中間体として残り、活性酸素種(ROS:reactive oxygen species)が生成します。ROSにはスーパーオキシド(O2-)、過酸化水素(H2O2)、ヒドロキシラジカル(・OH)、一重項酸素(1O2)、脂質ペルオキシドラジカル、次亜塩素酸(HOCl)などがあります。ROSには他の物質と反応して安定になろうとする性質があり、過剰になると共存するタンパク質・脂質・核酸などを酸化変性させてしまいます。例えば、DNA損傷の蓄積と老化のメカニズムの関係として、ラットの肝臓、腎臓、小腸などの臓器中では、DNAの酸化産物である8-OHdG(8-ヒドロキシ-2′-デオキシグアノシン)が加齢に伴って増加しています。また、ROSによってタンパク質は酸化し、断片化や架橋形成を引き起こすことも知られています。
ROSの生成は酸素呼吸を行う生物にとって避けることができない現象ですが、過剰な生成を抑え、早期に消去することがタンパク質の変性予防につながると考えられます。
カルボニルストレス
生体がROSなどによる酸化ストレスにさらされると、糖や脂質からアルデヒド基やカルボニル基を有する物質を生成します。これらの量が生体の消去能力を超えて増加した状態をカルボニルストレスといいます。アルデヒド基やカルボニル基を有する物質と、生体中のタンパク質や脂質が反応すると、変性して機能を失います(図1)。カルボニルストレスは糖や脂質からROSによって生成するカルボニル化合物との反応を含む、広義の糖化反応(メイラード反応)と考えられます。
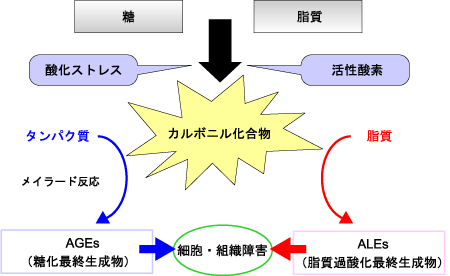
図1. カルボニルストレス
本来、DNAの遺伝情報に従って翻訳されたタンパク質は、糖鎖付加やリン酸化などの翻訳後修飾反応を経て、種々の生理作用を担っています。しかし、カルボニルストレスにより修飾を受けたタンパク質は、本来持つべき正常な機能を果たせなくなってしまい、その結果、老化や病気の発症・進展に繋がっていくと考えられています。
糖尿病では高血糖や活性酸素種によって生成したグリオキサール、メチルグリオキサール、グリセルアルデヒドなどのカルボニル化合物が、タンパク質を修飾してAGEs(advanced glycation end products:糖化最終産物)を生成します。また脂質過酸化が進行するとマロンジアルデヒドやヒドロキシノネナールなど脂質由来の中間生成物質により、脂質が修飾を受けALEs(advanced lipoxidation end products:脂質過酸化最終産物)を生成することも知られています。糖尿病ではカルボニルストレスが糖・脂質による非酵素的反応の広範な異常を示し、糖尿病性腎症などの合併症を発症・進展させると考えられています。
酸素呼吸は生命を維持する上で必須なためROSの生成を避けることができません。また糖や脂質は、生物の生命維持活動に不可欠なエネルギー源です。カルボニルストレスを抑制するためには、過剰なROSの生成を防ぐとともに、共存する糖や脂質の過剰な状態を避けることが重要であると考えられます。
TAGE病因説
「TAGE病因説」は、北陸大学・薬学部の竹内正義先生が提唱されている、生活習慣病の発症・進展に関する仮説で、生体において生体毒性が高く、直接的な病因物質になっているAGEsをTAGE(toxic-AGE)と命名し、生体中のTAGE生成回避・防御機構を推定したものです(図2)。
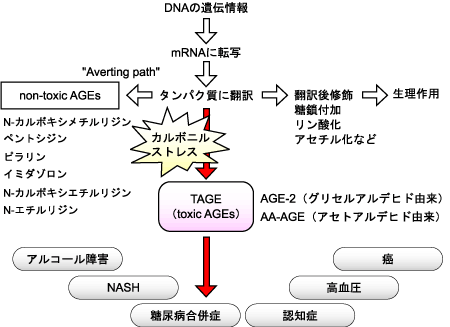
図2. TAGE病因説
竹内正義ら(生体の科学, 2007)より
AGEsはグルコースからだけでなく、グルコースの自動酸化物や分解産物より生成した、メチルグリオキサール(MGO)、グリオキサール(GO)、3-DG(3-デオキシグルコソン)などのジカルボニル化合物からも生成されることが知られています。
そこで、生成経路の異なる6種類のAGEs(グルコース由来:AGE-1(Glc-AGE)、グリセルアルデヒド由来:AGE-2(Glycer-AGE)、グリコールアルデヒド由来:AGE-3(Glycol-AGE)、MGO由来:AGE-4(MGO-AGE)、GO由来:AGE-5(GO-AGE)、3-DG由来:AGE-6(3-DG-AGE))が合成され(図3)、各AGE特異的な抗AGE抗体が作成されました。そして、糖尿病透析患者の血中に存在するAGEsの種類を調査した結果、6種類いずれのAGEsも存在していることが明らかになりました。さらにAGE-2とAGE-3はメサンギウム細胞にアポトーシスを誘導し、VEGFやMCP-1遺伝子の発現を誘導することや、AGE受容体の一種であるRAGE(receptor for AGEs)との結合性を有することが確認されました。これらの結果から、各種AGEsのうちAGE-2は生体毒性の高いAGE(TAGE:toxic-AGE)であると考えられました。
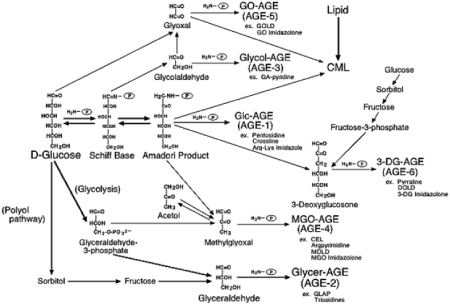
図3. AGEsの生成経路
Takeuchi et al.(J. Alzheimer’s Disease, 2009)より
TAGE病因説では、生体内で生成するカルボニル化合物を、RAGEに対する結合性がなく、毒性が低いCMLやペントシジン、ピラリンなどの AGEs(non-toxic AGEs)に積極的に変換させることで、毒性の高いAGE-2やアセトアルデヒド由来AGEs(AA-AGE)などのTAGE生成を防ぐ役割を果たしているのではないかと考えられています。
また近年、飲食品中に AGEs(AGE-1)を多く含む製品が多数市販されていることがわかってきました。また、食事によって食品から摂取された AGEs は 10% 程度が体内に取り込まれると考えられています。
AGEs の体内への取り込みや蓄積は、肝臓での AGEs受容体(RAGE)の発現およびTAGEの蓄積に繋がっていることが確認されています。よって、食事によって摂取された AGEs を効率良く排泄させることが、生体の保護に有用と考えられています。さらに AGEs の生成抑制に着目した食品の調理・加工方法の開発が必要であるとも言われています。
タンパク質の代謝回転
老化を分子レベルで見るとDNAに注目されますが、生命はDNAの遺伝情報に従って翻訳され、そこから作られたタンパク質で成り立っています。このため、タンパク質が異常になれば種々の生命活動に悪影響が出ると考えられます。仮にDNAや生体膜脂質が傷害を受けて異常になっても、その合成・分解や傷害修復に関わる酵素やタンパク質が適切に機能すれば、問題を回避して生命を維持できます。生体内では活性酸素による酸化亢進(カルボニルストレス)やグルコース(ブドウ糖)による糖化反応により、タンパク質に化学修飾が起こり、異常化します。加齢に伴う神経系・免疫系・内分泌系の機能、その他種々の細胞・組織機能の低下には、タンパク質の異常化が重要な役割を果たしていると考えられ、このようなタンパク質を「異常タンパク質」といいます。
異常タンパク質は生体内で機能しないだけでなく、積極的に障害をおよぼすこともあります。例えば、アルツハイマー病患者の脳に蓄積するβアミロイドは異常タンパク質の一種で、神経細胞を傷つけ、記憶や学習機能などの神経機能を低下させます。また、眼レンズ中のクリスタリンは加齢とともに変性し、凝集することによって濁りが発生し白内障を起こします。さらに、パーキンソン病、ハンチントン病、クロイツフェルト・ヤコブ病(プリオン病)など、多くの神経変性疾患はタンパク質が構造変化した異常タンパク質の蓄積によって発症することが明らかになっています。
通常、異常タンパク質はプロテアソームと呼ばれるタンパク質分解酵素によって分解されます。プロテアソームには26S(分子量250万)と20S(分子量70万)の2種類があり、どちらも多数のタンパク質分子からなる巨大分子の複合体です。多くの異常タンパク質は、ユビキチン化を受けたあと26Sプロテアソームによって分解されると考えられています。また酸化タンパク質は20Sプロテアソームでも分解されます(図4)。
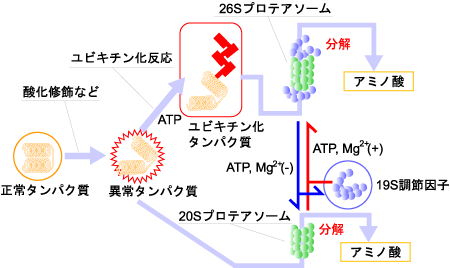
図4. プロテアソームによる異常タンパク質の分解
東邦大学バーチャルラボラトリー「健康長寿」より
生体はタンパク質の合成と分解という代謝回転を繰り返すことにより、細胞内で常に生じている異常タンパク質を除去し、分解によって生じたアミノ 酸を再利用して機能を維持しています。しかし、加齢に伴って細胞のタンパク質生合成活性が低下するため、高齢な動物では代謝回転が遅くなります。さらに高齢な動物の細胞はタンパク質の分解半減期が延びて壊れにくくなると共に、プロテアソーム自身が異常タンパク質化することで分解活性の低下が起こり、代謝回転が遅延することが確認されています。
以上のように活性酸素種(ROS)やカルボニルストレスがタンパク質の糖化を亢進し、異常タンパク質の蓄積やプロテアソームの異常タンパク質化による分解活性低下が老化を進展させると考えられています。従って老化抑制(アンチエイジング)には、タンパク質の変性が起こりにくい生体環境を作る「タンパク質ケア」が重要なポイントになると考えられます。
参考文献
-
- 繁田幸雄ら(編), 蛋白の糖化 AGEの基礎と臨床, 163pp, 医学書院, 1997.
- 山岸昌一(編), AGEs研究の最前線 糖化蛋白関連疾患研究の現状, 231pp, メディカルレビュー社, 2004.
- 米井嘉一, 抗加齢医学入門, p.306, 慶應大学出版会, 東京, 2004.
- 藤本大三郎, 老化のしくみと寿命, p.229, ナツメ社, 東京, 2001.
- 日本生科学会(編), 酸化ストレス・レドックスの生化学, 196pp, 共立出版, 2006.
- 竹内正義ら, AGEs(終末糖化産物)にはどのようなものがあるか 毒性終末糖化産物説, 生体の科学, 58(6), 502-511, 2007.
- Takeucch et al, Invoivement of toxic AGEs(TAGE) in the pathogenesis of diabetic vascular complications and Alzheimer’s disease, J. Alzheimers Dis, 16, 1-14, 2009.
- 後藤佐多良, 生体分子に起こる加齢変化, 東邦大学バーチャルラボラトリー, 健康長寿
http://www.mnc.toho-u.ac.jp/v-lab/aging/doc3/doc3-03-5.html
糖化と抗糖化 詳細目次
- 生体内糖化反応とAGEs
- 生体中糖化反応のモニタリング
- AGEsとポリオール代謝経路
- 糖化と糖尿病合併症
- 糖化と動脈硬化
- 糖化と骨疾患、アルツハイマー病
- 糖化と皮膚老化
- 糖化反応阻害剤(合成化合物、既存医薬品)
- 糖化反応阻害剤(ビタミン類、その他の物質)
- 天然物中の糖化反応阻害成分
- アンチエイジングと抗糖化
– 学術術情報一覧
