学術情報
糖化ストレスマーカーの測定法(1) 血糖、糖化蛋白、糖化反応中間体の測定
糖化ストレスマーカーの測定法(1) 血糖、糖化蛋白、糖化反応中間体の測定
糖化ストレスは高血糖とカルボニル化合物の生成・蓄積により亢進する。これら一連の反応は紫外線や酸化によって加速する。抗糖化は狭義の糖化反応だけでなく、広い概念である糖化ストレスへの対策としてとらえる必要がある。糖化ストレスの評価には生体中のグルコースと蛋白の非酵素的反応の過程で生じる様々な物質がマーカーとなる。
ここでは血糖、HbA1c、グリコアルブミン、糖化反応中間体の測定法について紹介する。
血糖の測定
血糖(グルコース)は食後の高血糖状態を評価する観点から糖化ストレスマーカーである。血糖値の測定は血糖自己測定(self-monitoring of blood glucose ; SMBG)が最も簡便な方法である。血糖の測定原理には酵素電極法と酵素比色(比色定量)法がある 1)。
酵素電極法には使用するグルコース分解酵素の違いにより、グルコースオキシダーゼ(glucose oxidase ; GOD)法とグルコースデヒドロゲナーゼ(glucose dehydrogenase ; GDH)法がある 2)。いずれも酵素により血中のグルコースが分解する際に生じる電子を、電子伝達体(メディエーター)であるフェリシアンイオンに与えてフェロシアン化イオンに変換する(図1)。この後、電極に一定電圧を加えた時に生じる電流が血中グルコース濃度に応じることから、電流量をグルコース濃度として測定する。
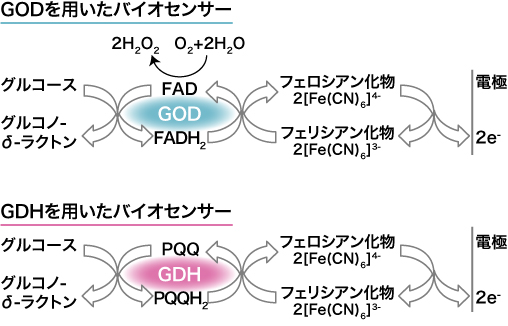
図1 酵素電極法によるグルコースセンサーの反応スキーム 2)
GOD:glucose oxidase , GDH:glucose dehydrogenase
酵素比色(比色定量)法には、ヘキソキナーゼ(hexokinase ; HX)法とグルコースオキシダーゼ / ペルオキシダーゼ(GOD / POD)法がある。HX法は血中グルコースをグルコース-6-リン酸(glucose-6-phosphate ; G6P)に変換した後、グルコース-6-リン酸脱水素酵素(glucose-6-phosphate dehydrogenase ; G6PDH)によってNADHとテトラゾリウムを生成させ、これらにジアホラーゼを作用させて青~赤色等に発色したホルマザンを比色定量する。GOD / POD 法は、 GOD の作用で血中グルコース量依存的に生じる過酸化水素を、POD(peroxidase)の作用で色原体と反応させ生成するキノン系色素を比色定量する。
SMBG ではヘマトクリット値が基準範囲付近(20~60%)である場合正確に測定できる。しかし貧血患者や透析患者のように 20% を下回る血液では高値に、新生児や生理前の女性などのように 55% を上回る多血症血で低値を示す。また GOD法は血液中の溶存酸素分圧が大きいほど血糖値が低く測定される 3)。
国内では複数のメーカーから、さまざまな特徴をもった SMBG機器が販売されており、用途に合わせた選択が可能である 4)。測定時間は機器によって異なるが 5~30 秒程度である。なお SMBG は薬事法で高度管理医療機器(クラスⅢ)に分類されているため広告宣伝が制限されている。
HbA1c、グリコアルブミンの測定
糖化反応は前期反応、中間体生成、後期反応に分けられる。前期反応で生成するアマドリ化合物には、 HbA1c やグリコアルブミン(glycoalbumin ; GA)などの糖化蛋白がある。これらは過去の血糖状態を反映する指標として糖尿病の評価に用いられており、血糖値と同様に有用な糖化ストレスマーカーである 5)。
HbA1c はヘモグロビンA のβ鎖N末端のアミノ酸であるバリンがグルコースとの糖化反応によりシッフ塩基を経て、ケトアミン化合物(糖化蛋白)となったものである。糖化反応は血中グルコース濃度に依存するため、高血糖の程度(濃度、時間など)に応じて生成物である HbA1c が増加する。生成した HbA1c は赤血球の寿命である 120 日間存在し続けるため、血中の総ヘモグロビン(ヘモグロビンA)に含まれる HbA1c の比率(%)が過去 1~2 ヶ月間の血糖状態を反映することになる。
HbA1c の測定には HPLC法、免疫法、酵素法がある 6)。 HPLC法はヘモグロビンをイオン交換クロマトグラフィーによって分離分析し、 HbA1c と総ヘモグロビンのピーク面積より HbA1c値を算出する。 HPLC法は HbA1c 以外に HbF(胎児型ヘモグロビン)や異常ヘモグロビンなども測定できるメリットがある。免疫法は HbA1c を抗原として作成された抗体を用いた測定法で、 HbA1c のみを選択的に測定することが可能である。特異性の高い抗体を用いているので HbA1c 以外のヘモグロビンの影響を受けにくい。酵素法はヘモグロビンのβ鎖N末端の糖化ジペプチドを蛋白分解酵素によって遊離させた後、フルクトシルペプチドオキシダーゼを用いた比色系で測定する。酵素法は自動分析装置を用いた大量検体処理に向いている。但し、免疫法や酵素法は HbA1c 値算出のために総ヘモグロビン量を別途測定する必要がある。また HbA1c の測定値は国際標準化が実施され NGSP(National Glycohemoglobin Standardization Program ; 国際標準)値が導入された 7)。これにより従来から日本国内の日常医療で使われてきた JDS(Japan Diabetes Society:日本糖尿病学会)値は、 NGSP値と比較する場合、約 0.4% 高値に補正する必要がある。
GA は血清アルブミンの糖化蛋白である。アルブミンの半減期は 20 日間前後であるため、過去 2週間~1ヶ月間の平均血糖値を反映する。このため GA は血糖値の変動幅が大きい糖尿病患者や薬物療法(インスリン投与など)を行っている患者にも適用できる。また、アルブミン分子内には糖化部位が 4カ所(Lys-199, 281, 439, 525)確認されており 8)、 HbA1c よりも血糖値の変動に比較的速やかに、大きく応答して推移する特徴がある。
GA の測定には HPLC法と酵素法があった。しかし現在、臨床検査で使用されている測定法は主に酵素法である。酵素法では血中のアルブミンを蛋白分解酵素によって分解して糖化リジン遊離させた後、ケトアミンオキシダーゼを用いた比色系で測定する。また別途、血中アルブミンをブロモクレゾールパープル(bromocresol purple ; BCP)法によって特異的に測定し、血中のアルブミンに含まれる GA の比率(%)を算出する。
HbA1c やグリコアルブミンは生活習慣病検診や献血時の血液検査の測定項目の一つにもなっており、臨床検査受託機関などで測定可能である。
糖化反応中間体
血中の糖化反応中間体には 3DG(3-deoxyglucosone)、グリオキサール(glyoxal ; GO)、メチルグリオキサール(methylglyoxal ; MG)、グリセルアルデヒド(glyceraldehyde)、グリコールアルデヒド(glycolaldehyde)などがある(図2)9)。
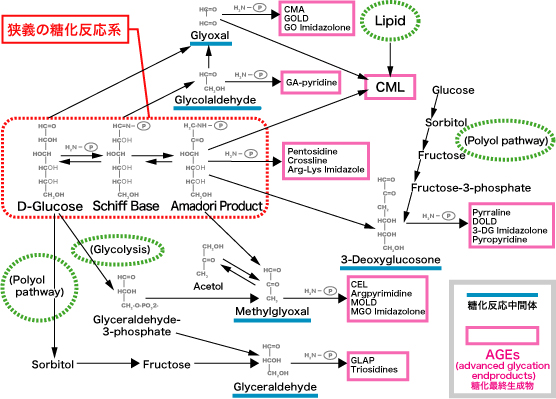
図2 糖化反応経路図
Takeuchi M, et al. 8)を改変
3DG はアマドリ化合物から生成するα-ジカルボニル化合物で、グルコースより 10,000 倍高い反応性を有し AGEs の生成に関与する。血漿中 3DG 濃度が 100 nmol/L 上昇すると糖尿病性網膜症、腎症のリスクが約 2 倍になる(図3)10)。

図3 糖尿病患者の血中 3DG 濃度と腎症、網膜症の進展度 10)
Benferroni / Dunn 多重比較検定
GO はグルコースの自動酸化や脂質の過酸化において生成する。 MGO は細胞内で解糖系やポリオール経路からも生成する。糖化反応中間体は化合物ごとに糖化反応経路が異なるため、最終的に生成する AGEs の種類が異なる。特にグリセルアルデヒドを中間体とする AGEs は toxic-AGEs(TAGE)とよばれ、糖尿病合併症の発症進展に深く関わっている 11)。
3DG、 GO、 MG は研究的にプレラベル化HPLC法で測定できる 12)。これらは血液サンプルを除蛋白した後、 2,3-diaminonaphthalene(DAN)を添加し、糖化反応中間体をアミノナフタレン誘導体化して精製後、逆相HPLC で測定する。アミノナフタレン化した糖化反応中間体の検出には、紫外光(波長 268 nm)または蛍光(励起波長 271 nm、蛍光波長 503 nm)が適用できる。
参考文献
-
- Benjamin EM, et al. : Clinical Diabetes. 2002; 20; 45-47.
- 田口尊之ら:化学と生物. 2008; 44: 192-197.
- 内潟安子:CDEJ News Letter. 2007;15: 7.
- 小林哲郎:糖尿病の最新治療. 2011; 2: 122-127.
- Tahara Y, et al. : Diabetes Care. 1995; 18: 440-447.
- Weykamp C, et al. : J Diabetes Sci Technol 2009; 3: 439-445.
- Goodall I. : Clin Biochem Rev. 2005; 26: 5-19.
- Ibreg N, et al. : J Biol Chem. 1986; 261: 13542-13545.
- Takeuchi M, et al. : Journal of Alzheimer’s Disease. 2009; 16: 845?858.
- Kusunoki H, et al. : Diabetes Care. 2003; 26: 1889-1894.
- 竹内正義:北陸大学紀要. 2004; 28: 33-48.
- Yamada H, et al. : J Biol Chem. 1994; 269: 20275-20280.
