学術情報
糖化ストレスと肝疾患
糖化ストレスと肝疾患
肝疾患とは
肝臓は基礎代謝の約25%を担う臓器で、糖質、脂質、蛋白、ビタミンの代謝や、有害物質の解毒、胆汁の分泌などをおこなっている。また肝臓は優れた再生能力を持っているため、肝細胞が破壊されても再生が可能な臓器である。一方、肝疾患(liver disease)には、肝炎(hepatitis)、肝硬変(cirrhosis)、脂肪肝(fatty liver disease)と病状をあらわすいくつもの病名がある。肝臓は肝疾患に対する自覚症状があらわれないことから「沈黙の臓器 (silent organ)」とも呼ばれている。
肝炎は病態により主に急性肝炎、慢性肝炎(6ヶ月以上炎症が続くもの)に分けられる。また、肝炎はその原因によってウイルス性(A型、B型、C型など)、アルコール性、薬物性、自己免疫性、その他に分類されている 1)。
A型肝炎はA型肝炎ウイルス(hepatitis A virus:HAV)による消化器感染症の一つである。汚染された貝類などの食品を食べて感染することが多く、また、衛生状態の悪い地域でよく見られる。子どもの時に感染した場合は、ほとんど不顕性感染で終るが、大人になってから感染すると発症することが多い。B型肝炎はB型肝炎ウイルス(HBV)によるもので、一過性のものと持続性のものがある。持続性のものは、ほとんど母子感染によるもので、多くの場合、急性肝炎となり慢性化しない。C型肝炎はC型肝炎ウイルス(HCV)によるもので、季節、年齢、性別を問わず発症する。輸血から生じる肝炎症例の大部分はC型肝炎が占めており、高い確率で慢性化する。
これまで肝疾患のひとつである肝癌の原因は、C型肝炎などのウイルス性肝疾患が大部分を占めていた。しかし近年、肝癌の原因は非ウイルス性の症例が増加し、その多くが脂肪肝(fatty liver)と考えられている。
脂肪肝は肥満、アルコール、糖分の摂り過ぎによるエネルギーの過剰、糖尿病、運動不足などが原因で起こる。健康であっても人はアルコール摂取量として日本酒に換算して、1日5合程度を1週間飲み続けると脂肪肝に至る 2-4)。アルコール性脂肪肝の人がさらに継続して大量飲酒すると、10~20%の人はアルコール性肝障害(alcoholic liver disease:ALD) を発症する。ALDはアルコール性脂肪肝、アルコール性肝炎、アルコール性肝硬変の順に進行する。
一方、脂肪肝には非アルコール性脂肪性肝疾患(nonalcoholic fatty liver disease:NAFLD)、さらに非アルコール性脂肪肝炎(nonalcoholic steatohepatitis:NASH)と呼ばれる病態がある。NASHは飲酒歴がないにもかかわらず、過食、運動不足、肥満、糖尿病、脂質異常症などに伴う脂肪肝を背景として発症する。NFLD患者は治療や介入がない場合、5~10年で5~20%が肝硬変や肝癌に至る 5)。NASHとALDには肝臓組織像に類似点があり、ともに発症メカニズムが研究されている。
肝疾患とAGEs
生体内で生成される様々な種類のAGEsの中では、グリセルアルデヒド由来AGEs(Glycer-AGEs)やアセトアルデヒド由来AGEs(AA-AGEs)が肝疾患に関与していることが報告されている 6)。
これまでAGEsは生体内において主にグルコースと蛋白から生成されると考えられてきた。しかし、グルコースの代謝中間体や分解物、糖化反応中間体、フルクトースなどからも生成されることが確認されている(図1) 7)。さらにグルコース由来AGEs(Glc-AGEs)やフルクトース由来AGEs(Fru-AGEs)に比べて、他のAGEsは早く生成する。例えば蛋白質が牛血清アルブミン(BSA)の場合は、Glycer-AGEs, グリコールアルデヒド由来AGEs(Glycol-AGEs)> メチルグリオキサール由来AGEs(MGO-AGEs), グリオキサール由来AGEs(GO-AGEs)>> 3-デオキシグルコソン由来AGEs(3-DG-AGEs)>>>Fru-AGEs > Glc-AGEs の順に生成しやすい。
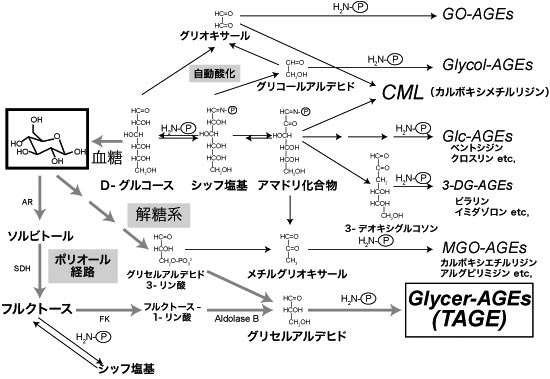
図1 生体内におけるAGEs生成経路
Glc-AGEs: グルコース由来AGEs,Fru-AGEs: フルクトース由来AGEs,Glycer-AGEs: グリセルアルデヒド由来AGEs,
Glycol-AGEs: グリコールアルデヒド由来AGEs,MGO-AGEs: メチルグリオキサール由来AGEs,
GO-AGEs: グリオキサール由来AGEs,3-DG-AGEs: 3-デオキシグルコソン由来AGEs,CML: N-カルボキシメチルリジン,
AR: アルドース還元酵素,SDH: ソルビトール脱水素酵素,FK: フルクトキナーゼ,H2N-P: 蛋白質中の遊離のアミノ基
竹内正義 (2012)3)
特にGlycer-AGEsはAGEs受容体(receptor for AGEs:RAGE)を介し、糖尿病血管合併症の発症や進展に強く関わっている 8-9)。Glycer-AGEsは肝細胞(hepatocyte)培養系に添加すると、炎症マーカーのひとつであるC反応性蛋白(C reactive protein:CRP)を上昇させることや、同様に肝細胞の線維化に関わる星細胞(hepatic stellate cell)培養系に添加するとRAGEを介して酸化ストレスを誘導して炎症を惹起する 10)。
さらに耐糖能異常のないNASH患者は肝臓内にGlycer-AGEsが蓄積していること 11)、ヒト肝臓癌細胞であるHep3B細胞培養系にグリセルアルデヒドを添加すると、肝細胞内のGlycer-AGEs量の増加に伴って細胞死を引き起こすこと、さらに分子シャペロンのひとつである heat shock cognate 70(Hsc70)がGlycer-AGEs化するとシャペロン活性が低下し、蛋白の機能不全を経て、肝細胞障害へ進展することも確認されている (図2)7,12)。
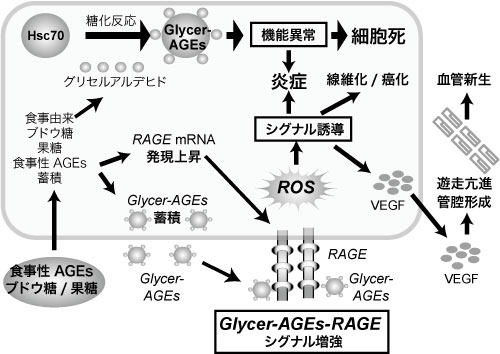
図2 NASHの発症・進展におけるGlycer-AGEsの肝細胞への影響
HSC-70: 熱ショック蛋白質-70,Glycer-AGEs: グリセルアルデヒド由来AGEs,
RAGE: AGEs受容体,ROS: 活性酸素種,VEGF: 血管内皮増殖因子,
竹内正義 (2012)3)
一方、アルコールの代謝物であるアセトアルデヒドの一部は、蛋白と結合してAA-AGEsを生成する(図3)。AA-AGEsは肝細胞障害作用が強く、主に中心静脈周囲の肝細胞で産生することからALDの発症や進展に強く関与している 13)。AA-AGEsはアルコール依存症者の血中や脳内に存在すること 14)、慢性アルコール投与ラットモデルにおいて中心静脈域の肝細胞に蓄積することも報告されている。これらのことから、アルコール代謝によってアセトアルデヒドが血中から消失した後も、AA-AGEsは神経細胞や肝細胞に毒性を及ぼしアルコール肝障害の発症進展に関与している可能性がある。
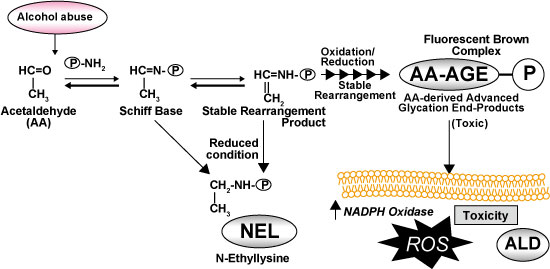
図3 アルコール摂取によるアセトアルデヒド由来AGEsの生成とその影響
Hayashi N, et al .(2013)14)
食事性AGEsの肝臓への影響
さまざまな食品の加熱・加工処理中には、食品中に各種AGEsが生成する。市販食品中には、主にGlc-AGEs と Fru-AGEs を含むものが多い。高Glc-AGEs含有飲料を正常ラットに経口投与し、Glycer-AGEsによるRAGE発現系を検討した結果では、肝臓における血管内皮増殖因子(vascular endothelial growth factor:VEGF)遺伝子の発現増大、肝臓でのGlc-AGEsおよびGlycer-AGEsの蓄積が認められている 15)。
また、2型糖尿病モデルラットを用いた制限給餌飼育実験系においては、食後の血糖変動に伴うGlycer-AGEの生成が確認されている 16)。また2型糖尿病患者にαグルコシダーゼ阻害剤を投与した場合、血中Glycer-AGEレベルは投与前と比べて有意に低下したことも報告されている 17)。さらにNAFLD患者では清涼飲料水からの糖質摂取量が健常者と比べて5倍多いことが報告されており、飲料に甘味料として添加される砂糖や果糖ぶどう糖液糖などの過剰摂取とNAFLDの発症進展との関わりが指摘されている。これらのことから食事由来のAGEsや食後高血糖は血中Glycer-AGEsレベルの上昇をもたらし、Glycer-AGEsによるRAGE発現系の相互作用を増強させ、肝疾患の原因となる可能性が示唆されている 18)。
参考文献
-
- 原田 尚 : 日内会誌. 1991 ; 80 : 1563-1567.
- Bellentani S, et al. : Gut. 1997 ; 41: 845–850.
- Becker U, et al. : HEPATOLOGY. 1996 ; 23 : 1025-1029.
- 石井裕正:日本内科学会雑誌. 2003 ; 92 : 45-49.
- 日本肝臓学会:NASH・NAFLDの診療ガイド2010
- 竹内正義:アンチエイジング医学. 2013 ; 8:55-61.
- 竹内正義:金医大誌. 2012 ; 37:141-161.
- 竹内正義ら:生体の科学. 2007 ; 58:502-511.
- Takeuchi M, et al. : Curr Drug Targets. 2010 ; 11 : 468-1482.
- Iwamoto K, et al. : J Gastroenterol. 2008 ; 43 : 298-304.
- Hyogo H, et al. : J Gastroenterol Hepatol. 2007 ; 22 : 1112-1119.
- Takino J, et al. : J Gastroenterol Hepatol. 2010 ; 45 : 646-655.
- Takeuchi M, et al. : J Neuropathol Exp Neuro. 2003 ; 62 : 486-496.
- Hayashi N, et al. : PLoS ONE 8(7) : e70034.
- Patel R, et al. : PLoS ONE 7(4): e35143.
- Kitahara Y. et al. : Clin Exp Med. 2008 ; 8 : 175-177.
- Tsunosue M, et al. : Clin Exp Med. 2010; 10 : 139-141.
- Sato T, et al. : Eur J Nutr. 2009 ; 48 : 6-11.
