学術情報
糖化ストレス対策 (3) AGEs の分解・排泄
糖化ストレス対策 (3) AGEs の分解・排泄
腎臓における AGEs排泄
蛋白の代謝によって血中に遊離した AGEs や食事によって腸管から吸収された AGEsは腎臓で尿中に排泄される。腎臓の近位尿細管にはメガリン(megalin)と呼ばれる膜受容体が存在し、尿から濾過された低分子蛋白を再吸収する。血中の AGEs は腎臓でメガリンと結合後、細胞が細胞外の物質を取り込む作用であるエンドサイトーシス(endocytosis)によって尿細管細胞に取り込まれる(図1)1)。しかし大量の AGEs がメガリンに取り込まれると、細胞内小器官の一つであるリソソーム(lysosome)での AGEs分解が飽和し、尿細管細胞内に AGEs が蓄積する 2-3)。このため腎機能が低下し AGEs の生体内蓄積が亢進する。
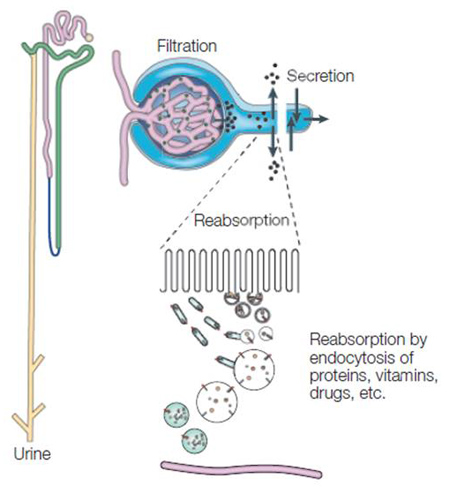
図 1. 腎臓における蛋白代謝排泄作用(Christensen et al. 1) を改変)
糖化・酸化ストレスによる蛋白修飾と代謝
加齢に伴う神経系・免疫系・内分泌系の機能、その他種々の細胞・組織機能の低下には、蛋白の異常化が重要な役割を果たしている。生体内では糖化ストレスや酸化ストレスにより、蛋白に化学修飾が起こり異常化する。このような蛋白は異常蛋白(altered proteins)と呼ばれ、生体内で機能しないだけでなく細胞や組織に障害をおよぼす 4)。アルツハイマー病(Alzheimer disease)患者の脳に蓄積するβアミロイド(β-amyloid)は異常蛋白の一種で、神経細胞を傷つけて記憶や学習機能などの神経機能を低下させる。また、眼レンズ中のクリスタリン(crystalline)は加齢とともに変性し、凝集すること(異常蛋白化)によって濁り白内障の原因となる。さらにパーキンソン病(Parkinson’s disease)など多くの神経変性疾患は構造変化した異常蛋白の蓄積によって発症する 5)。
通常、異常蛋白はプロテアソーム(proteasome)と呼ばれる蛋白分解酵素によって分解される。プロテアソームには26S(分子量250万)と20S(分子量70万)の 2 種類がある。多くの異常蛋白は、ユビキチン化を受けたあと 26Sプロテアソームによって分解される。また酸化蛋白は 20Sプロテアソームでも分解される(図2)5)。一方 AGEs化した蛋白は蛋白架橋の形成による硬化変性などにより、プロテアーゼによる分解を受けにくくなる 6)。
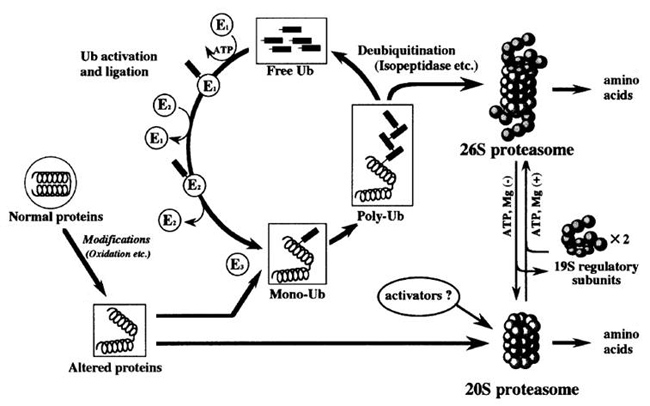
図 2. プロテアソームによるユビキチン化蛋白分解作用(Goto S, et al .(2001) 4))
生体は蛋白の合成と分解を繰り返すことにより、細胞内で常に生じた異常蛋白を除去し、分解によって生じたアミノ 酸を再利用して機能を維持している。しかし高齢な動物では、加齢に伴って細胞の蛋白合成能が低下するため代謝回転が遅くなる。さらに細胞蛋白は加齢に伴う AGEs化により分解されにくくなり、体内の異常蛋白量が増加する。
AGEs架橋の分解作用物質
蛋白の AGEs化に伴う架橋(AGEs-derived crosslink)の分解作用物質としては、N-phenacylthiazolium bromide(PTB)が知られている 7)。PTBは、糖化ストレスによって生じたアマドリ化蛋白由来の蛋白架橋物質(amadori-protein-ene-dion-derived)のαジケトン構造を認識して C−C結合を分解し、蛋白-蛋白架橋(protein-protein crosslink)を分解する(図3)7)。この作用により血管内の AGEs の蓄積抑制、糖尿病性血管合併症の治療などに寄与する可能性が示唆されている。糖尿病ラットに 4週間、 PTB を 10 mg/kg を経口投与した結果では、コラーゲンの AGEs架橋形成の抑制 7) および血管の AGEs分解に作用した 8) 。さらに PTB の水溶性を高めた 3-phenacyl-4,5-dimethylthiazorium chloride (ALT-711)を糖尿病ラットに投与した試験では、血管の硬化や AGEs蓄積抑制に作用した 9)。ALT-711をヒトが 8週間、 210 mg/day または 420 mg/day 経口摂取した臨床試験では、血管硬化(vascular stiffening)、収縮期血圧の不良(uncontrolled systolic blood pressure)の改善に効果を得た 10-11)。これらの結果から PTB は「 AGEs分解剤(AGE breaker)」と呼ばれている。
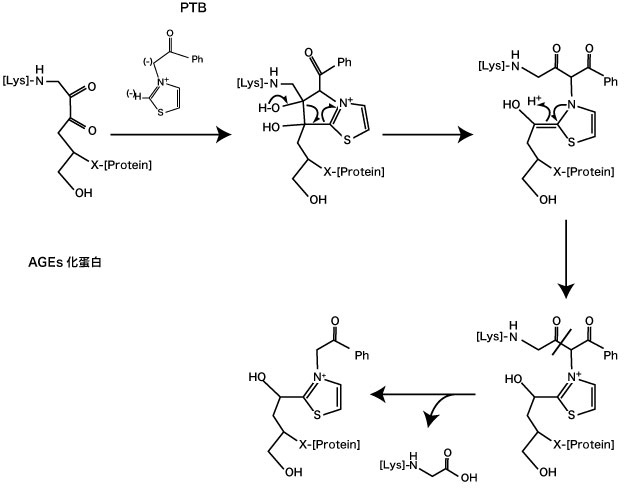
図 3. N-phenacylthiazolium bromide (PTB) のAGEs架橋分解作用(Vasan S, et al .(1996)7)
一方、 PTB は糖尿病ラットの皮膚および尾コラーゲンの AGEs架橋分解に効果がなかったとの報告があり 12)、 PTB の作用には懐疑的な見解もある。
PTB と同様の作用を有する植物成分としては、ヨモギ(Artemisia indica)、ルイボス(Aspalathus linearis)、レンゲソウ(Astragalus sinicus)13)、ユズ(Citrus junos)14)、ザクロ(Punica granatum)15) 抽出物が知られている。
ヨモギのエタノール抽出エキスである YACエキスは、コラーゲンゲル-グルコース反応系モデルで生成した AGEs の架橋(AGE-crosslink)を分解した。さらに YACエキスを配合した化粧水、乳液、クリームの 6 ヶ月間使用試験においては、皮膚弾力および肌の黄味(b*)改善に作用することが示唆された 13)。
ユズ(Citrus junos)に含まれるモノテルペンアルコール(monoterpene alcohols)の一種である terpinen-4-ol は、ヒドロペルオキシド(hydroperoxide)による求核置換反応(nucleophilic substitution)の後、バイヤー・ビリガー酸化(Baeyer-Villiger oxidation)タイプの反応によるカルボン酸エステル(carboxylate ester)の生成を経て、酸無水物(acid anhydride)の加水分解に至り、 AGEs架橋の分解に作用していることが示された 14)。
ザクロ果汁抽出物およびザクロ由来成分の AGEs架橋分解作用にはエラジタンニンのトリヒドロキシベンゼン(trihydroxybenzene)構造の関与が推定されている 15)。
これら天然物の AGEs架橋の分解作用は、既に蓄積した生体内AGEs の分解排泄に寄与する可能性がある。
酸化蛋白分解酵素による AGE分解作用13)
酸化蛋白質分解酵素(oxidized protein hydrolase:OPH)はセリンプロテアーゼ(serine protease)の一種で、ブタ肝臓、ヒト血液、ラット脳など、生体組織中に広く存在している(図4)16-17)。ヒト皮膚では角層中で存在が報告されている 18-19)。 OPH は蛋白の N 末端アシル化アミノ酸を遊離する酵素であることから、アシルアミノ酸遊離酵素(acylamino-acid releasing enzyme:AARE)としても知られている。 OPH は acyl化以外にも formyl、 acetyl、 butyl、 propyl化された蛋白質の N末端アミノ酸 20) および酸化・糖化修飾を受けた老化蛋白質の分解に作用する 21)。また OPH とプロテアソームは老化蛋白質の分解に協調して作用する 22)。糖尿病ラットでは血清中OPH 活性が顕著に上昇し、血中カルボニル修飾蛋白量が低くなる 23)。
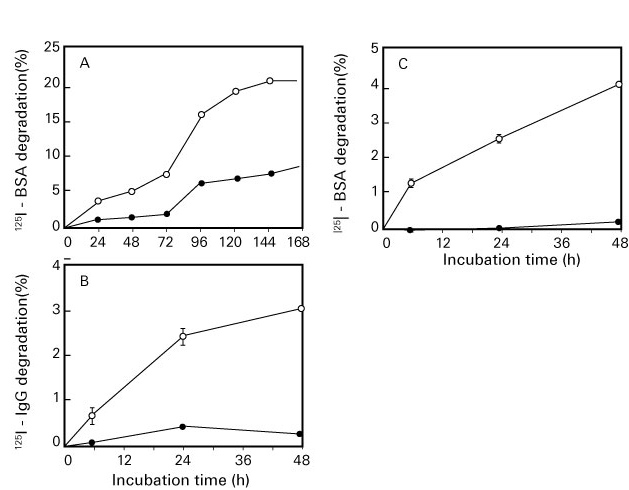
図 4. 酸化蛋白質分解酵素(OPH)の酸化・糖化蛋白分解作用(Fujino T, et al .21))
A:酸化牛血清アルブミン(BSA), B:酸化免疫グロブリンG(IgG), C:糖化BSA
●:無処理(コントロール), ○:酸化または糖化蛋白
OPH の活性に影響を与える天然物には茶、ハーブ、野菜類などの植物抽出物が知られている。ハーブ類や健康茶の中には OPH の活性を促進するものがある。一方、チャノキ由来の茶およびカテキン類は OPH活性を抑制する 24-26)。 OPH は生体組織中に広く存在する糖化蛋白および AGEs を分解する作用を有する。このため天然物による OPH の活性化は生体内AGEs の分解排泄促進に寄与する可能性がある。
参考文献
-
- Christensen E, et al.:Nat Rev Mol Cell Biol. 2002; 3: 256-266.
- Miyata T, et al.:Kidny Int, 1998 ; 53 : 416-422.
- Gugliucci A, et al.:Diabetologia, 1996 ; 39 : 149-160.
- Goto S, et al.:Ann N Y Acad Sci. 2001; 928: 54-64.
- Carrard G, et al.:Int J Biochem Cell Biol. 2002; 34: 1461-1474.
- Schnider, et al.:J Clin Invest. 1981; 67: 1630-1635.
- Vasan S, et al.:Nature. 1996; 382: 275-278.
- Cooper ME, et al.:Diabetologia. 2000; 43: 660-664.
- Freidja ML, et al.:Cardiovascular Diabetology 2014; 13: 55-71.
- Bakris GL, et al.:Am J Hypertens. 2004; 17: 23S-30S.
- Kass DA, et al.:Circulation. 2001; 104: 1464-1470.
- Yang S, et al.:Arch Biochem Biophys. 2003; 412: 42-46.
- 多田明弘:COSMETIC STAGE. 2011; 5: 33-38.
- Nagamatsu R, et al.:Biosci Biotechnol Biochem. 2012; 76: 1904-1908.
- Yagi M, et al.:Glycative Stress Research. 2015; 2: 58-66.
- Mitta M, et al.:J Biochem. 1998; 123: 924-931.
- Fujino T, et al.:J Biochem. 2000; 127: 1081-1086.
- 石神政道ら:第14回日本抗加齢医学会総会プログラム抄録集. 2014: 349.
- 石神政道ら:第15回日本抗加齢医学会総会プログラム抄録集. 2015: 239.
- Krishna RG, et al.:Protein Science. 1992; I: 582-589.
- Fijino T, et al.:J Biochem. 1998; 124: 1077-1085.
- Shimizu K, et al.:Biochemi Biophys Res Commun. 2004; 324: 140–146.
- Shimizu K, et al.:Biol Pharm Bull. 2009; 32: 1632-1635.
- 八木雅之ら:第13回日本抗加齢医学会総会プログラム抄録集. 2013: 253.
- 三橋璃子ら:第13回日本抗加齢医学会総会プログラム抄録集. 2013: 254.
- 三橋璃子ら:第14回日本抗加齢医学会総会プログラム抄録集. 2014: 362.
