学術情報
糖化ストレス対策 (1)血糖コントロール
糖化ストレス対策 (1)血糖コントロール
血糖と糖代謝のホルモン調節機能
生体内において細胞は血液よりグルコースを取り込んでエネルギー源であるATP (adenosine triphosphate)の合成に利用している。脳ではATPの合成をグルコースに依存している割合が大きいため血糖値が低下するとその影響を強く受ける。このためヒトの体では血糖値の低下を防いで上昇させるため、グルカゴン(glucagon)、成長ホルモン(growth hormone)、エピネフィリン(アドレナリン)(epinephrine または adrenaline)、副腎皮質ホルモン(corticosteroid)など複数のホルモンが存在する。これらのホルモンはグルコース輸送体による骨格筋や脂肪細胞へグルコースを取り込みや、細胞内での糖代謝をコントロールして血糖値の調節に作用する。一方、血糖値を低下させるホルモンはインスリン (insulin)しか存在しない。このアンバランスは人類が飢餓に対して生き延びるための備えと考えられている(図1)1)。
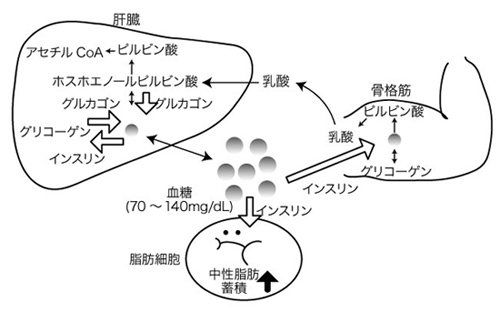
図 1. 糖代謝および血糖の調節機構
永井竜児ら(2013)1)
健康な人の血糖値は空腹時に70~90 mg/dL である。しかし、食後の血糖値は食事の量にもよるが140 mg/dL 程度まで上昇する。血糖値の上昇は脳の視床下部が感知し、副交感神経により膵臓のβ細胞(beta cells)に伝達され、インスリンの分泌が起こる。β細胞にはグルコース輸送体としてGLUT2(glucose transporter 2)が存在し、血糖値(血中のグルコース濃度)に依存してグルコースが細胞内に取り込まれる。これに伴ってβ細胞 は血糖値の上昇を感知してインスリンを分泌する。また、インスリンは骨格筋と脂肪細胞においてGLUT4(glucose transporter 4)を介したグルコースの取り込みを促進するとともに、解糖系に作用して糖代謝を促進する。この結果、食事の摂取によって上昇した血糖値は100 mg/dL 程度に低下する。
一方、血糖値の低下を視床下部が感知すると、交感神経により膵臓のα細胞(alpha cells)が刺激され、グルカゴンが分泌される。肝臓ではグルカゴンがグリコーゲンホスホリラーゼ(glycogen phosphorylase)をリン酸化することによって活性化し、貯蔵しているグリコーゲンが分解されてグルコースとなって血中に分泌され、血糖値が上昇する。
食事に伴う血糖値の変動は、主にこのようなホルモンの作用メカニズムよって食間に100 mg/dL 程度になるようコントロールされている。
糖質の消化吸収とインクレチン
食事に含まれる食品中の多糖類(糖質)は、唾液や膵液中のαアミラーゼによって二糖類に分解される。その後、小腸に到達した二糖類は微絨毛(microvillus)を有する粘膜上皮細胞の刷子縁(brush border)に存在するαグルコシダーゼ(α-glucosidase)によって単糖類に分解されて吸収される。αグルコシダーゼにはマルトース(maltose)を分解して2分子のグルコースに変換するマルターゼ(maltase)、ショ糖(sucrose)を果糖(fructose)とグルコースに分解するスクラーゼ(sucrase)、イソマルトース(isomaltose)を分解して2分子のグルコースに変換するイソマルターゼ(isomaltase)などがある 1)。
生体内では食事の摂取刺激により、小腸からグルコース依存性インスリン分泌刺激ポリペプチド(gastric inhibitory polypeptide:GIP)とグルカゴン様ペプチド-1(glucagon-like peptide-1:GLP-1)の2種類のホルモンが分泌される。これらの消化管ホルモンはインクレチン(incretin)とよばれている。さらに食事を継続摂取すると、増加したインクレチンによって膵臓β細胞が活性化してインスリン分泌が増加し、食後の血糖上昇が抑制される。インクレチンはインスリンの追加分泌を促進する消化管因子であり、インクレチンによるインスリン分泌促進が食後血糖値の恒常性に寄与している。
GIPを分泌するK細胞(K cell)は、主に十二指腸、空腸を中心とした小腸上部に局在する。一方、GLP-1を分泌するL細胞(L cell)は小腸下部に存在すると考えられている(図2)3)。K細胞とL細胞は腸管内に到達した栄養素を感知して、それぞれが細胞基底膜側にGIPとGLP-1を分泌する。GLP-1の血中濃度上昇は食事摂取直後からみられ、1~2時間継続する。GIPも同様に食事摂取直後から上昇し、数時間以上にわたって血中レベルが上昇する。インクレチンの分泌を促す栄養素としては糖質がある。糖質によるインクレチンの分泌はナトリウム依存性グルコーストランスポーター1(sodium-glucose cotransporter 1:SGLT1)によって吸収された糖質が、細胞膜の脱分極を起こすことによってGLP-1やGIPの分泌を促進すると考えられている。糖質以外にも蛋白質や脂質がインクレチンの分泌を促すと考えられている。
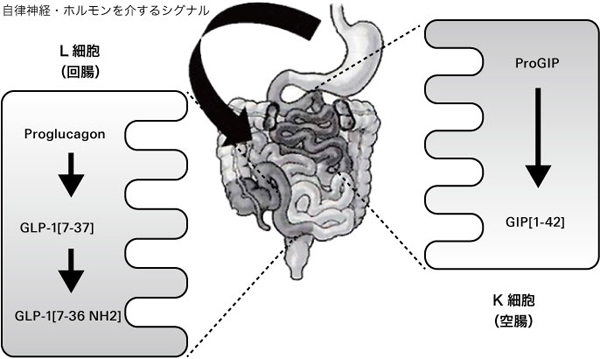
図 2. インクレチンの合成分泌
大杉 満(2010)3)
運動と糖代謝
血中のグルコース(血糖)はGLUT4を介して細胞内に取り込まれる。健常者では食事の摂取によって血糖値が上がると、それに見合った量のインスリンが膵臓から分泌される。その後、インスリンが細胞表面にあるインスリン受容体(insulin receptor)と結合すると、受容体は細胞内にグルコースを取り込むシグナルを出す。このシグナル伝達により、細胞内部にあるGLUT4は細胞の表面に出てきて、血液中のグルコースを細胞内に取り込む。しかし、加齢や糖尿病によってインスリンの働きが悪くなると、インスリン受容体を介したシグナルがうまく伝わらずGLUT4は細胞表面に出なくなり、血液中のグルコースを細胞内に取り込む作用が低下する(インスリン抵抗性:insulin resistance)。GLUT4が細胞の表面に出てくる数は運動による筋肉収縮刺激によっても増加する。さらにGLUT4が細胞の表面に出てくる数は運動を続けることによっても増えるため、グルコースの細胞への取り込みが多くなる。その結果、血糖値の恒常性は維持される 4)。
運動の効果は急性効果と慢性効果に分けられる。急性効果はエネルギー消費であり、骨格筋の筋収縮に伴うAMP/ATP の上昇をAMP キナーゼ が感知し、糖の取り込みを増大させることによって血糖値を下げるという仮説が提唱されている 5)。運動による糖輸送の促進はインスリン応答と異なる機序であるため、インスリン抵抗性を有する人においても運動により血糖値が低下する。食後30分~1時間は最高血糖値になるので、この時間帯に有酸素運動することで食後の血糖値の急上昇を抑えることができる 6)。
慢性効果にはインスリン感受性の増大がある。この機序にはGLUT 4 蛋白量の増加、運動筋への血流の増加、体脂肪の減少、インスリンシグナリング蛋白の増加などが示唆されている 7)。このため運動は血糖値の上昇を抑え、インスリン抵抗性の改善要因になる。
運動の種類としてはウォーキング、ジョギング、水泳などの有酸素運動、筋肉トレーニング、ストレッチングなどが有効とされている。
食事と酵素阻害剤
αグルコシダーゼ阻害剤(alpha glucosidase inhibitor:GI)は食事によって摂取した炭水化物の単糖への分解酵素の作用を阻害することで、上部小腸からの糖吸収を抑え、食後血糖値の上昇を抑制する薬剤である。日本ではアカルボース(acarbose, 医薬品名:グルコバイ)、ボグリボース(voglibose, 医薬品名:ベイスン)、ミグリトール(miglitol, 医薬品名:セイブル)の3剤が臨床で使われている。アカルボースとボグリボースは腸管から殆ど吸収されない。しかしミグリトールは一部が小腸で吸収されて腎臓から未変性のまま尿中に排泄される。アカルボースはαグルコシダーゼだけでなくαアミラーゼの作用も阻害する (図3)2)。
αグルコシダーゼ阻害作用は食品にも存在する。グァバ葉ポリフェノール(マルターゼ、スクラーゼ、アミラーゼ阻害作用)、小麦アルブミン(アミラーゼ阻害作用)、L-アラビノース(スクラーゼ阻害作用)、豆鼓エキス(αグルコシダーゼ阻害作用)などは食後の血糖値上昇を抑制する効果が期待される食品素材として、特定保健用食品に利用されている。
インクレチンは食事摂取後に消化管分泌細胞より分泌され、インスリン分泌を増強するホルモンである。しかし、インクレチンのうちGLP-1は全身に存在するdipeptidyl Peptidase-4(DPP-4)によって速やかに分解・不活性化されるため、血中半減期が1~2分と短い。このため近年、インクレチン関連薬が新しい糖尿病治療薬として注目を浴びている。日本ではDPP-4耐性のGLP-1受容体薬としてリラグルチド(liraglutide, 医薬品名:ビクトーザ)、エキセナチド(exenatide, 医薬品名:バイエッタ、ビデュリオン)、DPP-4阻害剤としてシタグリプチン(sitagliptin, 医薬品名:ジャヌビア、グラクティブ)、ビルダグリプチン(vildagliptin, 医薬品名:エクア)、アログリプチン(alogliptin, 医薬品名:ネシーナ)などが医薬品として承認されている 3)。
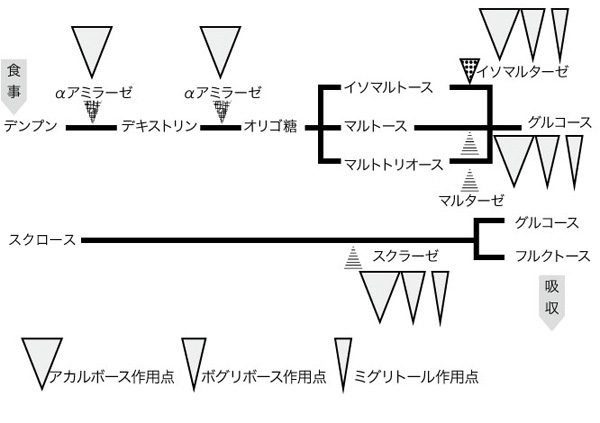
図 3. αグルコシダーゼ阻害薬の作用ポイント
藤原和哉ら(2010)2)
食後血糖値の上がりにくい食事
1981年に Jenkins らは食事の糖質量が同量であっても、それぞれの糖質主体の食品で血糖値を上昇させる速度や程度に差異がみられることを観察した(図4) 8)。その後、彼らは糖尿病でない健康なボランティアを用いて62種類の食品を50 g摂取したときと同量のブドウ糖摂取したときの食後の血糖曲線下面積(area under the glucose response curve:AUC)を相対比較することによって、食品のグリセミックインデックス(glycemic index:GI)を求めて表示した。以降、食品のGIは臨床現場において糖尿病やメタボリックシンドロームの食事指導における有効な情報の一つとして利用されている。一方、GIは糖質量を一定にして摂取した場合の糖質の「質」について血糖値への影響を示したものであるが、糖質を摂取する「量」によっても血糖値への影響が異なる。このためSalmeronらは1回の食事で摂取される糖質の「質」と「量」を勘案した指標として、グリセミックロード(glycemic load: GL)を考案した 9)。GLは食品の糖質量の割合を%で示し、その割合を食品のGIに乗じた値を算出する。
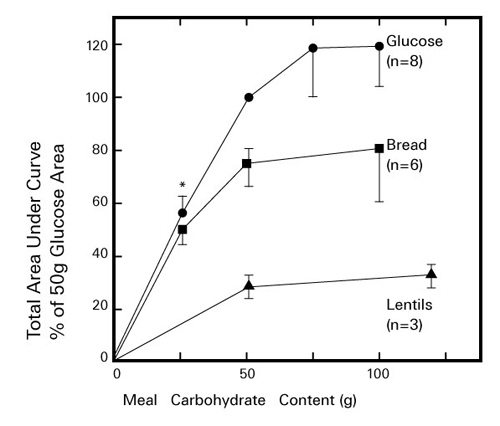
図 4. 健常者がグルコース、全粒粉パン、レンズ豆を摂取したときの血糖値変化
Jenkins DJA, et al.(1981)8)
一般にGI値70以上が高GI食品、56–69が中GI食品、55以下が低GI食品とされ、低GI食品を摂取したときは、高GI食品摂取時と比べてAUCが小さいため、食後血糖値の上昇が穏やかになることが期待される。GI値は食品中の炭水化物量、精製度、食物繊維量、脂質量、蛋白量、加工度などによって異なる。また、本来は炭水化物50 gを摂取した際の血糖値上昇の度合いを、同量のブドウ糖(グルコース)を基準食として100とした場合の相対値で表した指標である。しかしGI値として示されている情報には、基準食としている食品の種類(米飯、パンなど)や糖質量が異なるものがあるので注意が必要である。日本では日本Glycemic Index研究会(日本GI研究会)が包装米飯147 g(糖質50 g相当)を基準食とするプロトコル(統一手法)の実施を推奨している 10)。
また食品に食物繊維を添加することで食後血糖値の上昇を穏やかにすることができる。水溶性食物繊維である難消化性デキストリンは、炭水化物や単糖類と一緒に摂取すると水分で膨らみ、胃から腸への排出スピードを遅らせ、小腸で粘りのあるゲル状となって食物の拡散を妨げ、分解酵素が食物と接触しにくくなることで糖質の消化吸収を遅らせ、食後血糖値の上昇を抑制する。難消化性デキストリンを配合した食品は、食後の血糖値の上昇を抑制する効果が期待される食品素材として、特定保健用食品等に利用されている 11)。
一方、食事における食品の摂取順序によっても食後血糖値の上昇レベルは変わる。200 gの米飯と60 gの野菜(サラダ)の両方を摂取する際、野菜を米飯よりも先に摂取した方が血糖値の上昇およびインスリンの分泌が穏やかになることが報告されている 12)。この結果の公表がきっかけになり、食べる順番に基づく健康法が注目されている 13)。さらに食べる順番によらず、野菜、温泉たまご等の副菜をうどんや米飯に添えて同時に摂取することでも食後高血糖を抑制できることも報告されている(図5)14)。
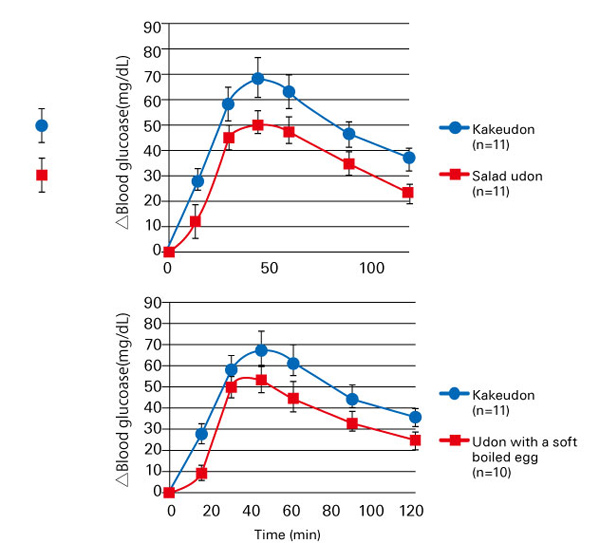
図 5. うどんにサラダまたは温泉玉子を添加して摂取したときの食後血糖値変化
Matsushima M, et al.(2014)14)
近年、血糖値の上昇に関与する食事中の炭水化物自体の摂取量を減らす糖質制限食が話題になっている。炭水化物は重要な栄養素の一つでもあり、極端な糖質制限が死亡リスクを高めるとの調査結果 15)も出ているので注意が必要である。
参考文献
-
- 永井竜児ら:基礎生化学 健康・疾病とのつながり. 2013, アイケイコーポレーション (東京).
- 藤原和哉ら:糖尿病の最新治療. 2010;2:6-15.
- 大杉 満:糖尿病の最新治療. 2010;2:21-26.
- 春日雅人:第116回医学会シンポジウム記録集 生活習慣と糖尿病の発症. 2000;13-18.
- Winder WW, et al.:Am J. Physiol. 1999;277:E1-E10.
- Derave W, et al.:Obesity. 2007;15:704-711.
- Chibalin AV, et al.:Pro Natl Acad Sci. 2000;97:38-43.
- Jenkins DJA, et al.:Am J Clin Nutr. 1981:362-366.
- Salmeron J, et al.:JAMA. 1997 ; 277:472-477.
- 日本Glycemic Index 研究会:http://www.gikenkyukai.com/protocol.html.
- 河合博成ら:健康・栄養食品研究. 2002;5:33-45.
- 金本郁男ら:糖尿病. 2010;53:96-101.
- 梶山静夫ら:なぜ、「食べる順番」が人をここまで健康にするのか:この食べ方で高血圧、糖尿病、高脂血症にならない! 2012, 三笠書房(東京).
- Matsushima M, et al.:Glycative Stress Research. 2014;1:53-59.
- Noto H, et al.:PLoS ONE 8(1):e55030. doi:10.1371 / journal.pone.0055030
