学術情報
糖化ストレスとは
糖化ストレスとは
糖化と AGEs
糖化(glycation)は 1912 年にフランスの科学者 Maillard によって発見されたアミノ酸・蛋白と還元糖の非酵素的な化学反応でメイラード(Maillard)反応とも呼ばれる 1)。
糖化は食品の加熱中に起こる着色、香りや風味の変化、保存期間中の栄養価低下に関わる反応であることから食品化学の分野で注目されてきた 2)。また、ヒト血中の糖化反応生成物であるヘモグロビン・エイワンシー(HbA1c)の測定は血糖コントロール指標として糖尿病治療分野で臨床応用されている。
糖化は生体内においてヘモグロビンだけでなく、アルブミン、ケラチン、グロブリン、コラーゲンなど様々な蛋白で起こり、 3-デオキシグルコソン(3-deoxyglucosone : 3DG)、グリオキサール(glyoxal : GO)、メチルグリオキサール(methylglyoxal : MGO)、グリセルアルデヒド(glyceraldehyde)、グリコールアルデヒド(glycolaldehyde)などのカルボニル化合物を中心とする中間体を経て、終末糖化産物(advanced glycation endproducts : AGEs)の生成に至ることが知られている。
AGEsはその生成過程において茶褐色、蛍光性(主に励起波長 370 nm、蛍光波長 440 nm)(図1)、蛋白架橋形成性を特徴とするが、各物質によってこれらの有無が異なる。
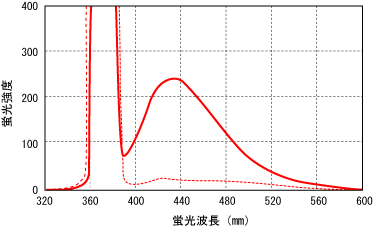
図1 ヒト血清アルブミン・グルコース反応中の AGEs 由来蛍光スペクトル
ヒト血清アルブミン(8 mg/mL)+ 0.05 mol/Lリン酸緩衝液(pH 7.4)+ グルコース(0.2 mol/L)(実線)
またはグルコースなし(破線)溶液を 60 ℃, 40 時間インキュベート, 励起波長 370 nm で蛍光スペクトル測定
蛍光性 AGEs にはペントシジン(pentosidine : 励起波長(ex)335 nm / 蛍光波長(em)385 nm)3)、クロスリン(crossline : ex 379 nm / em 463 nm)4)、ピロピリジン(pyrropyridine : ex 370 nm / em 455 nm)5) などがある。非蛍光性の AGEs には Nε-(carboxymethyl)lysine(CML)6)、 Nω-(carboxymethyl) arginine(CMA)7) などがある。ペントシジン、クロスリンは架橋性 AGEs である。
糖化ストレス
糖化ストレスとは、還元糖やアルデヒド負荷による生体へのストレスと、その後の反応を総合的にとらえた概念である(図2)。
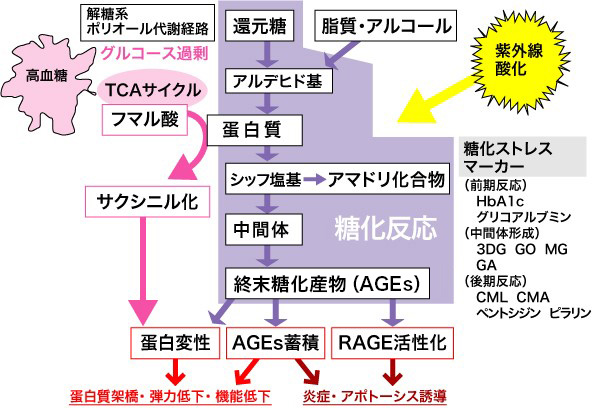
図2 糖化ストレスの概念図
3DG : 3-デオキシグルコソン、 GO : グリオキサール、 MG : メチルグリオキサール、 GA : グリコールアルデヒド、
CML : カルボキシメチルリジン、 CMA : カルボキシメチルアルギニン
狭義の糖化は、還元糖と蛋白の非酵素的な反応によりシッフ(Schiff)塩基の形成、糖化蛋白、様々な中間体形成を経て AGEs の生成に至る反応系である。この反応は組織蛋白を変性させて機能低下を起こす原因になる。
一方、生体内においては脂質のβ酸化や過酸化でもアルデヒド基とケトン基を生じる。アルデヒドやケトンの分子内に存在するカルボニル基は、電気陰性度の高い酸素原子に電子が引き寄せられると分極し、炭素原子は求核攻撃を受けやすくなる。さらに、これらの官能基が蛋白を構成するリジンやアルギニンと非制御的に反応すると、蛋白の機能性に障害が生じる。
また細胞内に過剰なブドウ糖が存在すると、 TCA 回路の反応不良を惹起してフマル酸の増加が生じる 8-9)。フマル酸は蛋白を構成するアミノ酸であるシステインと反応して S-(2-succinyl)cysteine(2SC)を形成する。この反応はサクシニル化と呼ばれ、蛋白のサクシニル化により機能性が低下あるいは喪失することで生体内に障害が惹起される。サクシニル化を受ける生体内の蛋白には、細胞骨格蛋白、熱ショック蛋白 8)、アディポネクチン 9) などがある。
さらに組織内に蓄積した AGEs は、 AGEs 受容体である RAGE(Receptor for AGEs)と結合して細胞シグナルを活性化し、炎症性サイトカイン生成を惹起する 10)。 RAGE は細胞内シグナル伝達から細胞応答を生じ AGE 受容体として病態形成に働いている 11)。
AGEs 以外で RAGE に結合するリガンドとしては、酸化損傷生成物で酸化ストレスメディエーターの一種である advanced oxidation protein products(AOPP)、アルツハイマー病で脳内に蓄積するアミロイドβ蛋白、家族性アミロイドポリニューロパチーで蓄積する transthyretin、癌転移との関連および炎症との関連が指摘されている High mobility group B-1 (HMGB-1)/amphoterin、炎症性メディエーターS100蛋白、白血球表面の Mac1 がある 3)。また、 AGEs のうち CML、グリセルアルデヒド(glyceraldehyde)およびグリコールアルデヒド(glycolaldehyde)修飾物質は RAGE 結合性が高いとされている 12)。
糖化ストレスは蛋白の機能障害、蛋白の変性(翻訳後修飾)、老廃物の蓄積、 TCA サイクルの障害、細胞内シグナルの活性化や組織障害の惹起、加齢に伴う退行性変化などを促進する要因になっている。また紫外線や酸化ストレスは糖化ストレスを加速する要因として位置づけられる。
アンチエイジング医学における糖化ストレス
ヒトは食物中の炭水化物を主要なエネルギー源としているため、生存期間中に血糖(グルコース)と蛋白の間で起こる糖化を避けることができない 13)。このことは健常者の皮膚コラーゲン中 AGEs 蓄積量が加齢と共に増加していること、糖尿病患者で同年齢の健常者よりも多いこと 14)、糖尿病患者の皮膚弾力性が非糖尿病患者と比べて低下していること 15) などから明らかになっている。
糖化による AGEs の生成・蓄積は、糖尿病合併症だけでなく、皮膚老化 16)、アルツハイマー病 17)、高血圧 18)、動脈硬化症 19)、骨粗鬆症 20) などの進展に関与している。特に皮膚、骨、軟骨などコラーゲン組織の AGEs 化は組織の褐色化と弾力性の低下を伴うため、美容や健康分野で注目されている。
アンチエイジング医学は予防医学の一つで、生活の質(quality of life : QOL)の改善と健康長寿を目指す学問である 21)。ヒトの老化の表現型には、血管の老化(動脈硬化)、神経の老化(認知症、アルツハイマー病)、骨の老化(骨粗鬆症)などがある。しかし個人差があり、さらに各個人が抱える老化の危険因子はそれぞれ異なる。
このため、アンチエイジングドックでは老化度(機能年齢)を筋年齢、血管年齢、神経年齢、ホルモン年齢、骨年齢として評価する 22)。さらに機能低下に関与している要因を老化危険因子として位置づけ、免疫ストレス、酸化ストレス、心身ストレス、糖化ストレス、生活習慣に分けて評価する(図3)。
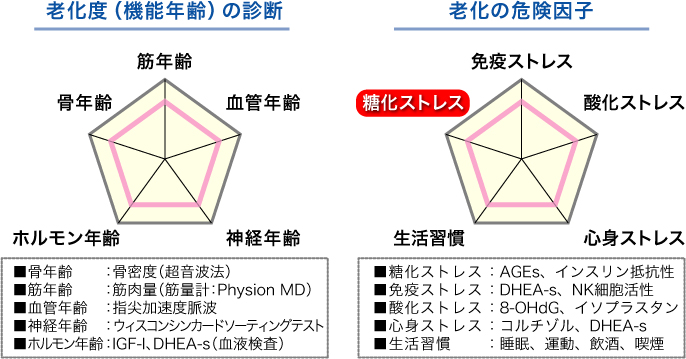
図3 アンチエイジングドックにおける老化の評価
アンチエイジングドックによる評価結果は、老化度が最も高い項目および老化の危険因子が最も大きな項目に着目し、突出して老化している項目を是正し、老化度の全体のバランスをとることを目標にしている。
アンチエイジング医学における糖化ストレスは、還元糖やアルデヒド負荷による生体へのストレスと、その後の反応を総合的にとらえた影響として老化危険因子の一つととらえられている。
参考文献
- Maillard LC. Compt Rend Acad Sci (Paris). 1912; 154: 66-68.
- Friedman M. J Agric Food Chem. 1996; 44: 631-653.
- Sell DR, et al. : J Biol Chem. 1989; 264: 21597-21602.
- Obayashi H, et al. : Biochem Biophys Res Commun. 1996; 226: 37-41.
- Hayase F. Food Science and Technology Research. 2000; 6: 79-86.
- Ahmed MU, et al. : J Biol Chem. 1986; 261: 4889-4894.
- Iijima K, et al. : Biochem J. 2000; 347: 23-27.
- Nagai R, et al. : J Biol Chem. 2007; 282: 34219-34228.
- Frizzell N, et al. : J Biol Chem. 2009; 284: 25772-25781.
- Yamagishi S, et al. : J Biol Chem. 1997; 272: 8723-8730.
- Nagai R, et al. : Anti-Aging Medicine. 2010; 7: 112-119.
- Yamamoto Y, et al. : Diabetes Res Clin Pract. 2007; 77: S30-40.
- Cerami A, et al. : Sci Am. 1987; 256: 90-96.
- Dyer DG, et al. : J Clin Invest. 1993; 91: 2463-2469.
- Kubo M, et al. : Journal of Clinical Biochemistry and Nutrition. 2008; 43(Suppl 1): 66-69.
- Reiser KM, et al. : Pros Soc Exp Biol Med. 1998; 8: 23-37.
- Reddy VP, et al. : Neurotox Res. 2002; 4: 191-209.
- Miranda TS, et al. : Hypertension. 2005; 46: 232-237.
- Brownlee M, et al. : Science. 1986; 232: 1629-1632.
- Saito M, et al. : Osteoporos Int. 2006; 17: 986-995.
- 米井嘉一. 抗加齢医学入門 改定第2版. 慶應義塾大学出版会(東京) 2011.
- 吉川敏一(監修). アンチエイジングドック. 診断と治療社(東京) 2007.
