学術情報
糖化ストレスと腎疾患
糖化ストレスと腎疾患
腎疾患とは
腎臓は腹部背面の左右に1個ずつある豆型の臓器である。腎臓の主な働きは以下の5つである(図1)1-2)。
- 生体中の老廃物を尿として体外に出す
- 体に必要な電解質を再吸収し、体の電解質の濃度を一定に保つ
- レニンという酵素を産生し、血中の血管収縮作用物質(アンジオテンシンⅡ)をコントロールして血圧を調節する
- エリスロポエチンを分泌し、骨髄に赤血球を作らせる
- ビタミンD を活性型ビタミンD3 に変換して、骨にカルシウムを沈着させる
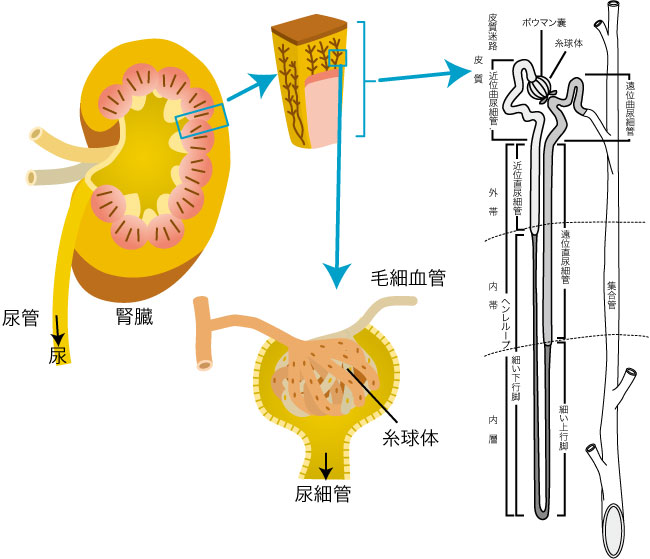
図1 腎臓の構造
貴堂明世(2014)1)と坂井建雄(2011)2) を改変
腎機能が低下すると、体には老廃物や余分な水分がたまってむくみが出る、電解質のバランスが崩れる、血圧が上がる、貧血になる、骨がもろくなるなど、さまざまな症状が出る。腎疾患には慢性腎炎(慢性糸球体腎炎)、糖尿病性腎症、腎硬化症、多発性嚢胞腎、ネフローゼ症候群など、さまざまな種類がある。一方、 2002年に米国腎臓財団(national kidney foundation)から腎臓の慢性経過不全の未病状態から末期までを包括する疾患として慢性腎臓病(chronic kidney disease;CKD)という概念が提唱され、腎機能の低下状態を示す診断指標として認識されるようになった 3)。
日本における腎臓透析患者数は 2012 年末現在 30 万人を超えており、さらに毎年 5,000~6,000人増え続けている 4)。このため腎疾患は国民病と言っても過言でない。一方、腎臓透析導入の原因疾患は、第一位が糖尿病性腎症(44.1%)、第二位が慢性糸球体腎炎(19.4%)、第三位が腎硬化症(12.3%)である。糖尿病性腎症は 1998年に現在第二位の慢性糸球体腎炎との間で順位が入れ替わって以降も増加を続けていることから、糖化ストレスが腎疾患の進展要因として注視されている。
糖尿病性腎症の発症は継続的な微量アルブミン尿(20~200 μg/min)から始まる。微量アルブミン尿状態が放置された場合、 1型糖尿病ではその後 15年間のうちに 80%の患者が顕性アルブミン尿(>200 μg/min)に至り、そのうちの 50%が 10年間のうちに末期腎臓病(end-stage kidney disease;ESKD)に移行する。 2型糖尿病では 20~40%が顕性アルブミン尿に至り、そのうちの 20%がその後の 20年以内に ESKD に移行する 5)。
腎臓における AGEs 排泄
腎臓は AGEs の排泄・蓄積抑制に重要な役割を果たしている。腎臓の近位尿細管にはメガリンと呼ばれる膜受容体が存在し、尿から濾過された低分子蛋白を再吸収する。生体内で生成して血中を巡る低分子 AGEs は、腎臓でメガリンと結合後、エンドサイトーシスによって尿細管細胞に取り込まれる。しかし大量の AGEs がメガリンに取り込まれるとリソソームでの AGEs 分解が飽和してしまう。この結果、尿細管細胞内に AGEs が蓄積することになる 6-7)。
また、腎臓は食事により吸収した AGEs の代謝排泄にも関与している。ラット静脈中にペントシジンを投与すると 35%が腎臓に蓄積したこと 6)、低 AGEs 食を摂取した健常者では尿中 AGEs 濃度が低下したことも報告されている 7-8)。
AGEs と糖尿病性腎症
糖尿病性腎症の組織学的特徴には糸球体基底膜の肥厚とメサンギウム基質の増加がある。また糸球体基底膜、メサンギウム、ポドサイト、尿細管細胞、内皮細胞など、さまざまな細胞や部位に AGEs の蓄積が見られる(図2)9-10)。そして最終的には糸球体硬化を伴う腎不全に至る。
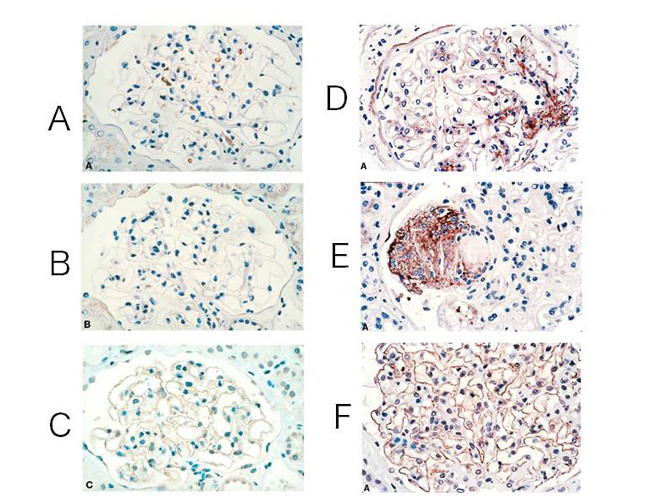
図2 腎糸球体への CML、ペントシジン蓄積と RAGE 発現
(A)~(C) ; 健常者の糸球体, (D)~(F) ; 中度糖尿病患者の糸球体
(A)(D) ; CML 抗体染色, (B)(E) ; ペントシジン抗体染色, (C)(F) ; RAGE 抗体染色
Tanji N. , et al. (2000)9) を改変
糖尿病性腎症の原因は高血糖の持続であり、発症から腎不全に至る進展過程には複雑な要因が関与している。糖尿病発症後早期に糸球体に起こる最も大きな変化は糸球体過剰濾過と糸球体高血圧がある。糸球体の過剰濾過と糸球体内圧の上昇は内皮細胞を傷害しマクロファージの浸潤や血小板凝集が起こる。これらの細胞から放出されるサイトカインなどは、メサンギウム細胞からの細胞外基質の産生を亢進させ、糸球体硬化を進行させる。さらにメサンギウム細胞の伸展刺激も細胞外基質の産生を亢進させる。また、高血糖によって引き起こされる細胞内のジアシルグリセロールの増加によるプロテインキナーゼC(protein kinase C;PKC)の活性の増加や,糖化ストレスや酸化ストレスによって生成する AGEs の蓄積が腎症の重要な進展因子となる11)。
また近位細尿管細胞の萎縮や尿細管間質の線維化も進行する。これら組織学的変化の要因には代謝異常、血流変化、サイトカインや増殖因子 TGF-β(transforming growth factor-β)の発現も関与している。
糖化ストレス対策の糖尿病性腎症治療への応用
アミノグアニジン(aminoguanidine)やチアゾリン誘導体である OPB-9195((+/-)-2- isopropylidenehydrazono-4-oxo-thiazolidin-5-ylacetanilide)の AGEs 生成阻害剤に尿蛋白や腎臓の組織学的変化を抑制する作用が認められている 12-14)。しかしこれらの薬剤は副作用が強く臨床応用が見込めない。現在、チアミン(ビタミンB1)15)、ピリドキサミン(ビタミンB6類似化合物)16)に糖尿病患者の腎機能改善効果が確認されている。
また進行性の糸球体硬化と腎機能の低下を特徴とするマウス(OVE26)の RAGE を欠損させると腎機能の改善が認められたことから 17)、糖尿病性腎症の発症に RAGE が関与し、 RAGE が治療のターゲットになる可能性が示唆されている。さらに生体中に存在するジカルボニル化合物消去酵素の一種であるグリオキサラーゼ1(glyoxalase 1;GLO1)の活性を亢進させると、酸化ストレスや腎臓の老化が軽減されたことから、 GLO1 に基づく創薬が期待されている 18)。
参考文献
-
- 貴堂明世 : 図解でわかる糖尿病. 片山隆司(編). 2014; 48-49.
- 坂井建雄 : 日腎会誌. 2001; 43: 572-579.
- 槇野博史ら : CKD治療ガイド2012. 日本透析医学会(編). 日腎会誌. 2012; 54: 1031-1189.
- 日本透析医学会 : 図説 わが国の慢性透析療法の現況. 2012年12月31日現在. 2013;
- 城愛理ら : AGEsと糖尿病性腎症. AGEsと老化. 太田博明(監), メディカルレビュー社. 2013: 125-133.
- Miyata T, et al. : Kidny Int. 1998; 53: 416-422.
- Gugliucci A, et al. : Diabetologia. 1996; 39: 149-160.
- Foesrter A, et al. : Biochem Soc Trans. 2003; 31: 1383-1385.
- Tanji N, et al. : J Am Soc Nephrol. 2000; 11: 1656-1666.
- Biohlender JM, et al. : Am J Physiol Renal Physiol. 2005; 289: F645-F659.
- 四方賢一ら : 糖尿病性腎症, プロスタサイクリンの多様性と今後の展望, メディカルレビュー社. 2002; 165-171.
- Soulis-Liparota T, et al. : Diabetes. 1991; 40: 1328-1334.
- Tsuchida K, et al. : Diabetologia. 1999; 4: 579-588.
- Bolton WK, et al. : Am J Nephrol. 2004; 24: 32-40.
- Rabbani N, et al. : Diabetologia. 2009; 52: 208-212.
- Lewis EJ, et al. : J Am Soc Nephrol, 2012; 23: 131-136.
- Reiniger N, et al. : Diabetes. 2010; 59: 2043-254.
- Rabbini N, et al. : Semin Cell Dev Biol. 2011; 309-317.
