学術情報
糖化ストレスマーカーの測定法(2) AGEsの測定
糖化ストレスマーカーの測定法(2) AGEsの測定
糖化ストレスの評価には生体中のグルコースと蛋白の非酵素的反応の過程で生じる様々な物質がマーカーとなる。ここではAGEsの測定法および生体中のAGEsを非侵襲測定する方法について紹介する。
AGEsの測定
後期反応で生成する血中の AGEs には、カルボキシメチルリジン(Nε-carboxymethyl lysine ; CML)1)、ペントシジン(pentosidine)2)、カルボキシメチルアルギニン(Nω-carboxymethylarginine ; CMA)3) など様々な物質がある。
CML は GO(glyoxal)を中間体としてリジンから生成する非蛍光性・非架橋性AGEs で、糖尿病や酸化ストレス亢進時にも生成する。CML化したコラーゲンをヒト皮膚線維芽細胞の培地中に添加するとアポトーシスが誘導される 4)。皮膚では比較的代謝回転の速い表皮層にも存在する 5)。角層中の CML蓄積は肌のキメ喪失に関与している 6)。
ペントシジンはリボース、アルギニン、リジンから効率良く生成する蛍光性・架橋性AGEs で、腎症の早期臨床マーカーの1つとして保険適用になっている。近年、血中・尿中ペントシジンは骨質の老化を反映するマーカーとして注目されており、骨粗鬆症診断への利用が期待されている 7)。さらにペントシジンは皮膚コラーゲン中にも存在して加齢と共に増加する。糖尿病患者の皮膚中ペントシジン蓄積量は同年齢の健常者よりも高い 8)。
CMA は GO を中間体としてアルギニンから生成する AGEs の一種で、コラーゲン中に特異的に存在する 3)。
血中CML、ペントシジンの測定 9-10) には ELISAキットが数社から販売されているので利用できる。但し、生体試料中の AGEs を測定する上では、測定対象とする糖化反応生成物の特性に合致した処理が必要になる。血液サンプルは CML やペントシジン測定時に高温で加熱処理すると、サンプルの前処理途中で AGEs が人為的に生成して測定値の高値化誤差を生む要因になる 11)。
ペントシジンの測定には高値化誤差を避ける方法として HPLC法がある。 HPLC法では、血清サンプルを塩酸加水分解した後、イオン交換カラム等による前処理によってサンプル中の夾雑物を除去し、逆相HPLC によりペントシジンを分離分析する(図1)12)。ペントシジンの検出にはペントシジンの特異的蛍光(励起波長 335 nm, 蛍光波長 385 nm)を用いる。但し HPLC法においては、前処理時の回収率低下、測定ピークへの夾雑物の混入回避、多検体測定が困難などの課題がある。
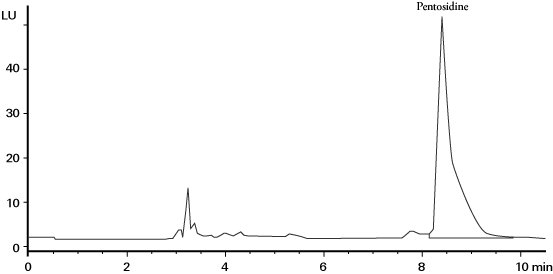
図1 HPLC法による血清ペントシジンの測定クロマトグラム 12)
カラム : Vydac 218TP54(250 x 4.6mm ID, 5 µm)
溶離液 : 0.1% HFBA / acetonitrile(82.5 / 17.5), 流速 : 1.0 mL/min,
温度 : 30℃, 検出:蛍光(ex 330 nm / em 375 nm)
AGE Reader® による皮膚中AGEs の非侵襲測定
皮膚中の AGEs蓄積は肌のハリや弾力の低下など、皮膚老化要因の一つと考えられている。皮膚中の蛍光性AGEs蓄積量はAGE Reader(DiagnOptics社製)により、非侵襲的に皮膚の蛍光強度(auto fluorescence ; AF)として測定することができる 13-14)。
AGE Reader は糖尿病合併症の進展リスクを評価する目的で研究開発された皮膚中の AGEs蓄積量を非侵襲的に測定する臨床用検査機器である 15-17)。本機器は皮膚に紫外線を照射した時に、組織内に蓄積した蛍光性AGEs が励起されて特有の自己蛍光を発する性質を利用して AGEs を測定する(図2)。
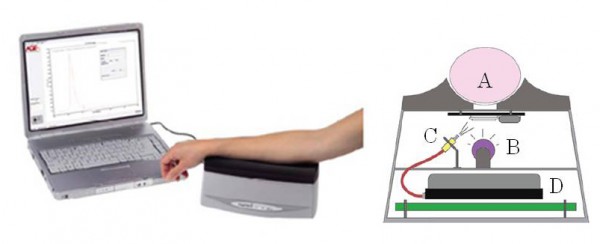
図2 AGE Reader ® の測定システムと本体構造模式図
A : 腕 (測定部位), B : 光源(Black light), C : グラスファイバー, D : 分光器
AGE Reader の測定システムでは、箱型(280(縦) × 150(横) × 115(高)mm)の本体内に設置された光源(UV-A black-light)から 345 ~ 410 nm(極大波長 365 nm)の波長の光が、約 2 × 2 cm のガラス窓を通って皮膚表面に励起光として照射される。本機器では励起光により皮膚から発した 420~600 nm の蛍光をグラスファイバーにより分光器に導入し、得られた情報を専用のソフトウェアで解析して AF を算出する 18)。測定時間は約90秒(3回測定モードの場合)である。AGE Reader では蛍光と同時に白色LED光による皮膚反射光(reflection ; Ref)も測定し、Ref が 12%未満の場合に測定値の補正が行われる。しかしRefが 6%未満の場合は測定できない。このため被験者の皮膚色が濃褐色、皮膚色の黒い人(Fitzpatrick class 5-6 skin color)は測定できない。また測定値は日焼け止め剤などを含むスキンケア化粧品等の使用に影響を受けるため、測定前に測定部位を十分洗浄しておく必要がある。
皮膚AF は励起光(300~420 nm)に対する蛍光(420~600 nm)強度の割合から算出され、任意の単位(arbitrary units ; AU)で表示される。AGE Reader によって算出される AF は、被験者の性別、年齢などを加味してメーカーが蓄積したデータとの比較グラフとともに出力される。しかし,AF の解析式はメーカーから公開されていない。
AGE Reader で測定されるAF値は、皮膚色の白い人(Fitzpatrick class 1-3 skin color)における糖尿病患者と健常者における加齢との関係が示されており、加齢や糖尿病により高値化する。
メーカーが推奨している皮膚AGEs測定部位は前腕部である。前腕部での測定は測定時における被験者への動作負担が少ない反面、季節により被験者の紫外線暴露の影響を大きく受ける。皮膚色の白い人を対象にした測定部位の比較結果では、前腕や下肢が糖尿病合併症と強い相関を示している 19)。
一方、日本人の皮膚は紫外線を浴びると赤くなり、皮膚色が濃くなる。このため日本人を対象とした測定の場合、紫外線の影響を受けにくく、皮膚計測検査で推奨される上腕内側部である、右腕肘の先端から約 10cm 離れた部位で安定した測定が可能である(図3)20-21)。AGE Reader による皮膚AGEs測定部位は紫外線の影響、皮膚色、測定対象とする人種によって適切に選択する必要がある。
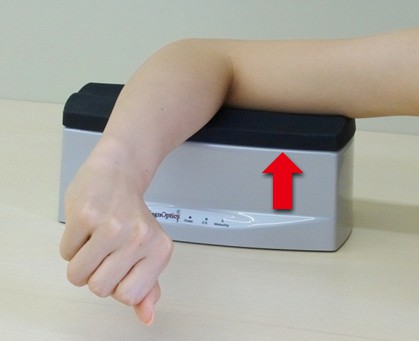
図3. AGE Reader ®での上腕内側部の測定
赤矢印は測定部位を示す
テープストリッピング法による角層CML の測定
角層は皮膚の最外層に位置し、角層細胞と細胞間物質から構成されている。角層は表皮層から次々と産生される角層細胞と表面からの剥離脱落により常に再構成され、水分保持、バリア性の保持などの生体防御機能を維持している。一方、加齢による皮膚変化の研究は組織学的観点から行われることが多く、生化学的な観点で簡単に測定する方法は少ない。
角層の機能を非侵襲的に評価する方法としては、角層細胞を粘着テープで剥離採取するテープストリッピング法が知られている。テープストリッピング法では脱落角質細胞数、角質細胞面積、細胞形態や核の残存率測定などの形態学的な評価方法が報告されている。
一方、テープストリッピング法により剥離採取した角層からは蛋白、ケラチン 22)、カテプシン 23)、トランスグルタミナーゼ 24)、アルギナーゼ 25) などの生化学的な測定が報告されている。
テープストリッピング法による角層CML の測定は、皮膚蛋白中の糖化ストレス状態を簡便に採取して直接測定できる 26)。角層は市販の粘着シートとして角質チェッカー AST-01(アサヒバイオメッド社製)等を、被験者の右上腕内側部に 5秒間程度指で押しつけた後、皮膚からテープを剥がして採取する(図4)。角層を採取した粘着シートは細断後、Tris-HCl 緩衝液(pH 7.5)中でマイクロホモジナイザーなどを用いて、粘着シート表面の粘着剤を掻き取るようにホモジナイズ後、角層抽出液を回収する。角層抽出液中の CML の測定には市販の ELISA法による測定キットを使用する。また同時に別途、角層蛋白抽出液中の蛋白量を測定し、角層蛋白あたりの CML量を算出する。

図4 角層テープストリッピング方法
上腕内側部
参考文献
-
- Nagai R, et al. : Biochem Biophys Res Commun. 1997; 234: 167-172
- Sell DR, et al. : J Biol Chem. 1989; 264: 21597-21602
- Iijima K, et al. : Biochem J. 2000; 347: 23-27.
- Alikhani Z, et al. : J Biol Chem. 2005; 280: 12087-12095.
- Kawabata K, et al. : Biochimica et Biophysica Acta. 2011; 1814: 1246?1252.
- 五味貴優 : BIO INDUSTRY. 2011; 28: 20-26.
- Saito M, et al. : Osteoporos Int. 2006; 17: 986-995.
- Dyer DG, et al. : J Clin Invest. 1993; 91: 2463-2469.
- Tahara N, et al. : Cardiovascular Therapeutics. 2012; 30: 42?48.
- Sanaka T, et al. : Nephron. 2002; 91: 64-73.
- Nakano M, et al. : Anti-Aging Medicine. 2010; 7: 92-93.
- Slowik-Zylka D, et al. : J Biochem Biophys Methods. 2004; 61: 313-329.
- Meerwaldt R, et al. : Diabetologia. 2004; 47: 1324-1330.
- Meerwaldt R, et al. : J Am Soc Nephrol. 2005; 16: 3687-3693.
- Meerwaldt R, et al. : J Am Soc Nephrol. 2005; 16: 3687-3693.
- Lutgers HL, et al. : Diabetes Care. 2006; 29: 2654-2659.
- Nomoto K, et al. : Anti-Aging Medicine. 2010; 7: 73-84.
- AGE Reader User manual Ver2.3, DiagnOptics, pp29.
- Tanaka K, et al. : Ther Apher Dial. 2010; 14: 334-340.
- Nomoto K, et al. : Anti-Aging Medicine. 2012; 9: 165-173.
- Miyazaki R et al. : Anti-Aging Medicine. 2009; 6: 83-94.
- 公開特許公報(A), 特開2008-249429.
- 田原祐助ら:BUNSEKI KAGAKU. 2009; 58: 15-19.
- 公開特許公報(A), 特開2001-29099.
- 公開特許公報(A), 特開2010-151482.
- Kamitani Y, et al. : Anti-Aging Medicine. 2013; 10: 55-59.
