学術情報
糖化ストレスマーカーの測定法(3) 抗糖化作用の評価
糖化ストレスマーカーの測定法(3) 抗糖化作用の評価
2009年秋頃から化粧品・美容・健康食品・アンチエイジングの分野において「抗糖化(anti-glycation)」をキーワードとした素材、製品、生活習慣などが注目されている。ここではアンチエイジング医学の観点から抗糖化作用の評価方法について、事例を交えて紹介する。
天然物のin vitro抗糖化作用評価
天然物の抗糖化作用を評価するには、ヒト血清アルブミン(human serum albumin : HSA)などのモデル蛋白と、グルコース、フルクトースなどの還元糖および評価する素材(被験物質)をリン酸緩衝液(pH 7.4)中で 60℃、 40時間反応させる。その後、反応液中AGEs量を被験物質の有無で比較し、 AGEs生成阻害率(%)を算出する。HSAとグルコースを 60℃で 40時間インキュベートした時の AGEs の生成レベルは、37℃で約60日に相当する(図1)1)。
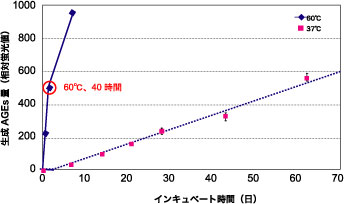
図1 ヒト血清アルブミン・グルコース反応中の AGEs生成量
ヒト血清アルブミン(8 mg/mL) + 0.05 mol/Lリン酸緩衝液(pH 7.4) + グルコース(0.2 mol/L),
60℃(実線), 37℃(破線), 励起波長 370 nm, 蛍光波長 440 nmで測定, n = 3
抗糖化作用の評価にはAGEs由来の蛍光測定(励起波長 370 nm、蛍光波長 440 nm)が最も簡便である。蛍光性AGEs にはペントシジン(pentosidine : 励起波長(ex) 335 nm / 蛍光波長(em) 385 nm)2)、クロスリン(crossline : ex 379 nm / em 463 nm)3)、ピロピリジン(pyrropyridine : ex 370 nm / em 455 nm)4) などがある。反応液中には CML、ペントシジン、 3DG、 GO、 MGO も生成するので、これらの生成量を各方法で測定することもできる。抗糖化作用は、添加する被験物質の濃度を 3濃度以上設定して反応させた後、各反応液中の AGEs や糖化反応中間体の測定値をもとに被験物質の 50% 生成阻害濃度(50% inhibitory concentration : IC50)を算出する。
AGEs生成阻害作用の陽性対照としては糖化反応阻害剤であるアミノグアニジン(aminoguanidine)が汎用される。アミノグアニジンは糖尿病合併症治療を目的として開発された医薬品の一つで、糖化反応中間体分子内のカルボニル基を封鎖する AGEs生成阻害薬である 5)。しかし日本国内においては副作用などの影響により医薬品承認されていない。
in vitro 抗糖化作用評価系では、種々のAGEs物質を測定することにより、複雑多経路である糖化反応に対する素材の作用ポイントを推定することができる 6)。前記評価系は、混合ハーブ 7)、紫菊花 8)、クマイザサ 9)、健康茶 10)、フルーツ 11)などの多くの素材抽出物の抗糖化作用スクリーニングに用いられている。評価方法は多少異なるが、茶葉 12)、ハーブ 13)、スパイス 14)、生薬 15) などさまざまな植物素材にも抗糖化作用の存在が報告されている。抗糖化作用は主に植物中に含まれるポリフェノール類によるものと推定されている。
一方、チャノキ(Camellia sinensis)に含まれるカテキン(catechin)、エピカテキン(epicatechin)などのフラボノイド類(flavonoids)や、ヌルデ(Rhus javanica)の虫こぶ(五倍子)に多く含まれる没食子酸(gallic acid)など、カテコール(catechol)骨格を有する化合物は 10 μmol/L 以下の低濃度で CML の生成を抑制するが、 1 mmol/L 以上の高濃度になると CML生成を促進することが報告されている(図2)16-17)。天然物に含まれる抗糖化成分の作用メカニズムは十分解明されておらず、これらの利用に注意が必要である。
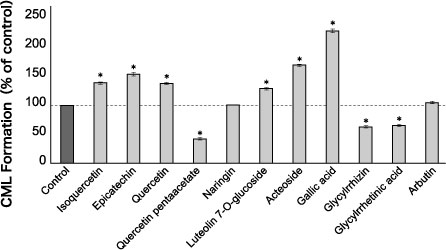
図2 天然物の CML生成作用
HSA 2 mg/mL + リボース 5 mg/mL + 被験物質 1 mmol/L, 37℃, 10日間インキュベート
CML : ELISA法により測定, *P < 0.01 vs control
Fujiwara Y, et al (2011)7)
抗糖化素材の臨床評価
in vitro 抗糖化作用の評価が得られた場合、ヒト臨床試験によって効果を検証することになる。臨床試験の実施には安全性の担保が必須である。このため被験食とする素材や物質は、食薬区分、ヒトでの食経験調査、急性毒性試験(単回投与毒性試験)、亜急性毒性試験(反復投与毒性試験)、復帰突然変異試験(Ames 試験)、DNA修復試験(Rec-assay)、残留農薬試験などにより、食品としての安全性を確認する必要がある。さらに可能であれば含有成分の無毒性量(no observed adverse effect level : NOAEL)、無影響量(no observed effect level : NOEL)、一日摂取許容量(acceptable daily intake : ADI)、耐容一日摂取量(tolerable daily intake : TDI)との関連性も調査しておきたい。これらの結果を評価するには「健康食品の安全性評価ガイドライン」18) 、「錠剤、カプセル状等食品の原材料の安全性に関する自主点検ガイドライン」19)、「医薬品開発におけるヒト初回投与試験の安全性を確保するためのガイダンス」20)、「医薬品開発と適正な情報提供のための薬物相互作用ガイドライン(案)」21)などが参考になる。
ヒト臨床試験は、被験食の安全性を明確にした上でヒト臨床試験プロトコルを作成し、ヒト試験倫理委員会の承認を得た上で、被験者募集を行い、被験者へのインフォームドコンセントを得て試験を実施する。臨床試験の成否は被験食の抗糖化作用の強弱のみならず、被験者の健康状態にも影響される。試験前に AGEs 蓄積量が少なく、糖化ストレスの低い被験者は抗糖化作用素材や物質の摂取による変化が少ない。健常者を対象とする試験の場合、被験者は糖代謝異常などの疾患がなく、食後血糖値が高く、皮膚中AGEs蓄積量が多い人、すなわち糖化ストレスのレベルが高いヒトを対象とすると抗糖化作用の影響が現れやすい。
抗糖化素材「AGハーブMIX TM」の研究開発事例
我々は食経験豊富なハーブであり、植物分類学的に異なるグループに属するドクダミ(Houttuynia cordata)、セイヨウサンザシ(Crataegus laevigata)、ローマカミツレ(Chamaemelum nobile)、ブドウ(Vitis vinifera)抽出物中に、 HSA に対する in vitro抗糖化作用(蛍光性AGEs 生成阻害作用)を見出し、抗糖化食品素材「AGハーブMIX」として製品化した 22)。この素材開発を例に抗糖化素材の安全性・機能性の評価例を紹介する。
まず in vitro抗糖化作用のスクリーニングによって得られた前記 4 種類の植物エキスには、 3DG、ペントシジン、 CML の生成阻害作用に違いが見られた。しかしこれらをブレンド抽出することで、さまざまな AGEs の生成を抑制する混合ハーブエキスにすることができた。また混合ハーブエキスは牛皮由来Ⅰ型コラーゲンに対しても抗糖化作用を有すると共に、コラーゲン特異的に生成する AGEs の一種である CMA の生成も抑制することもわかった。その後、混合ハーブエキスはストレプトゾトシン糖尿病誘発ラットに対する投与試験を実施し、アミノグアニジンと同等の抗糖化作用を示すことを確認した 23)。
次いで、混合ハーブエキスを AGハーブMIX として製品化し、食品としての安全性を、食経験の調査、急性毒性試験、 DNA修復試験、残留農薬試験などにより確認すると共に、ヒト試験倫理委員会の承認および被験者へのインフォームドコンセントを実施し、健常者に対して AGハーブMIX 3,000 mg/日(摂取目安量の 5 倍)の 2 週間連続摂取試験を実施した。その結果、 AGハーブMIX の摂取が、肝機能、腎機能、糖・脂質代謝機能、ヒトの薬物代謝機能などに悪影響を及ぼす可能性が低いことを確認した。
さらに、同様の実施手順で糖尿病予備群(随時血糖値が 110~199 mg/dL かつ HbA1c(JDS値)が 5.5~6.5%)の方を対象として、 AGハーブMIX 3,000 mg/日または同量のプラセボ食を摂取するダブルブラインド並行群間比較試験を実施した 24)。その結果、摂取開始 8週間後に血糖値 110 mg/dL 以上のサブグループ解析において、試験食摂取群がプラセボ食摂取群よりも血中3DG の増加抑制傾向(p = 0.094)、 HbA1c 5.9% 以上のサブグループ解析において CML に有意な減少(p = 0.048)が認められた(図3)。
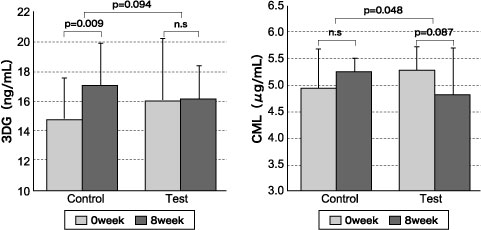
図3 混合ハーブエキス摂取前後の血中糖化反応生成物量変化
糖尿病予備群(随時血糖値が 110~199 mg/dL かつ HbA1c(JDS値)が 5.5~6.5% の方)における 110 mg/dL以上のサブグループ解析結果
Control : プラセボ食摂取群(N=8), Test : 試験食摂取群(N=11), 対応のある t検定
また、同様の実施手順で実施した 2型糖尿病患者(HbA1c(JDS値) : 5.7~9.2%)に対する AGハーブMIX 600 mg/日、 12週間の連続摂取試験では 25)、血中3DG が摂取開始 8、 12週間後に有意に減少した(p < 0.001)。また血中CML は 12週間後に有意に減少した(p < 0.001)。また、皮膚弾力性は摂取開始 8週間後(p = 0.001)、 12週間後(p < 0.001)に皮膚弾力指数(R2 : Ua/Uf)が有意に改善した(図4)。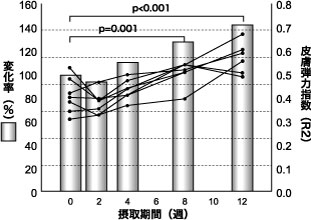
図4 混合ハーブエキス摂取開始後の皮膚弾力性変化
2型糖尿病患者 7名 (HbA1c(JDS値) : 5.7~9.2%)
R2:キュートメーターによる測定値解析パラメーター, Dunnettの多重比較検定
次いで、同様の実施手順に従って、閉経後で糖化ストレスの強い女性(米飯摂取 60分後の血糖値と皮膚AGEs蓄積量が高い)に対して、難消化性デキストリン 5 g/日 および AGハーブMIX 100 mg/日を含む酢飲料(試験食品)を 8週間連続摂取するダブルブラインド並行群間試験を実施した 26)。その結果、テープストリッピングにより測定した皮膚角層CML量(変化比)が、 200 g 米飯摂取 60分後の血糖値が 150 mg/dL 以上のサブクラス解析において、摂取開始 8週間後に試験食品群で有意に低下した(p = 0.025)(図5)。
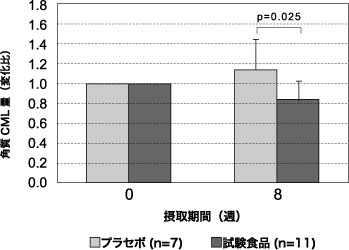
図5 混合ハーブエキス配合酢飲料摂取後の角層CML量変化
200 g 米飯摂取 60分後の血糖値が 150 mg/dL 以上のサブクラス解析結果対応のある t検定
このように臨床評価は抗糖化作用を確認した素材の安全性を十分確認した上で、測定評価対象とする糖化ストレスマーカーを in vitro 試験の結果や期待される作用から設定し、試験プロトコルを作成し、ヒト試験倫理委員会の承認を得たうえで実施する必要がある。
抗糖化作用データの示し方
in vitro抗糖化作用は被験物質の IC50 で示され、陽性対象としたアミノグアニジンの作用との比較で評価されることが多い。しかし IC50 は in vitro抗糖化作用の評価系に使用する蛋白や糖の種類および濃度、反応温度や時間、測定するAGEsの種類によっても変わる。このため他の文献のデータと比較するためには測定条件を合わせる必要がある。また天然物中の作用成分は物質同定されていない場合が多いので、抽出液の固形分量(蒸発残分)や総ポリフェノール量などを基準に IC50 が算出される。さらに糖化反応経路は多経路であり、生成する AGEs も多種存在する 6)。このため抗糖化作用の評価データは、素材や物質がどの AGEs生成経路に対して作用する可能性があるのか、個別に検証する必要もある。
最終的に抗糖化作用の有用性はヒト臨床試験で作用確認される。この場合、摂取する素材や物質の in vitro抗糖化作用の評価で得られた作用点をもとに、評価する糖化ストレスマーカーが選定される。摂取量は米国で実施されたアミノグアニジンの大規模臨床試験結果、既に製品化されている抗糖化素材の臨床評価データなどを目安に設定されている。アミノグアニジンは、 1日あたり 150 mg または 300 mg を 6~36ヵ月間の連続摂取した時、糖尿病性腎症の改善が示されている 5)。臨床試験では血中や皮膚中AGEs の生成・蓄積抑制作用だけでなく、皮膚の張り・弾力、くすみ、キメなどの皮膚指標の変化をモニターして抗糖化作用の老化予防に対する有用性が示される。
参考文献
-
- Hori M, et al. : Anti-Aging Medicine. 2012; 9, 125-134.
- Sell DR, et al. : J Biol Chem. 1989; 264, 21597?21602.
- Obayashi H, et al. : Biochem Biophys Res Commun. 1996; 226, 37-41.
- Hayase F : Food Science and Technology Research. 2000; 6, 79-86.
- Bolton WK, et al. : Am J Nephrol. 2004; 24, 32-40.
- Takeuchi M, et al. : Journal of Alzheimer’s Disease. 2009; 16, 845?858.
- Yonei Y, et al.: Anti-Aging Medicine. 2008; 5, 93-98.
- Yagi M, et al.: Anti-Aging Medicine. 2012; 9, 61-74.
- 堀未央ら:同志社大学理工学研究. 2011; 52, 61-67.
- Hori M, et al. : Anti-Aging Medicine. 2012; 9, 135-148.
- Lanny P, et al. : Anti-Aging Medicine.2013; 10, 70-76.
- Kinae N, et al.: The maillard reaction in the food processing human nutrition and physiology. 1990; 221-226.
- Matsuura N, et al. : J Health Sci. 2002; 48, 520-526.
- Dearlove RP, et al. : J Med Food. 2008; 11, 275-281.
- Yokozawa T, et al. : J Trad Med. 2001; 18, 107-112.
- Fjiwara Y, et al. : Ann NY Acad Sci. 2008; 1126, 152?154.
- Fujiwara Y, et al. : Free Radical Biology & Medicine. 2011; 50, 883?891.
- (財) 日本健康・栄養食品協会. 2008.
- 厚生労働省 : 食安発第0201003号. 2010.
- 厚生労働省 : 薬食審査発0402第1号. 2012.
- 厚生労働省 : 意見募集, 案件番号495130206号. 2013.
- 八木雅之ら : COSMETIC STAGE. 2011; 15, 23-32.
- Yonei Y, et al. : Anti-Aging_Medicine. 2008; 5, 93-98.
- Yonei Y, et al. : Anti_Aging_Medicine. 2010; 7, 26-35.
- Kubo M, et al. : J Clin Biochem Nutr. 2008; 43(suppl 1), 66-69.
- Yagi M, et al. : Glycative Stress Research. 2014; 1, 14-24.
