学術情報
生体中糖化反応のモニタリング
生体中糖化反応のモニタリング
前期反応生成物
タンパク質は生体を構成する成分の約15%を占め、水分(約60%)、脂肪(約20%)に次いで多い。また、ヒトは炭水化物を分解して得られるグルコースを主なエネルギー源として生命活動をしている。このため我々はタンパク質とグルコースの非酵素的反応である糖化反応(グリケーション)の影響を避けることができない。生体内では糖尿病のように血糖値の高い状態が続く疾患だけでなく、正常な血糖値であっても、加齢に伴ってさまざまなタンパク質の糖化反応が進行する(表1)。臨床検査においては、過去の平均血糖値のモニタリングを目的に糖化反応生成物の測定法が確立されてきた。これらは前期反応生成物であるアマドリ化合物を測定対象にしている。
| マトリックスタンパク質 | コラーゲン ミエリン フィブロネクチン フィブリン |
| 膜タンパク質 | 赤血球グルコース輸送タンパク質 赤血球スペクトクリン 赤血球膜タンパク質 内皮細胞膜タンパク質 |
| 細胞内タンパク質 | ヘモグロビンA 水晶体クリスタリン チューブリン カルモジュリン |
| 酵素 | カテプシンB リゾチーム 膵リボアーゼ 銅/亜鉛スーパーオキシドジスムターゼ 炭酸デヒドラクターゼ β-N-アセチルヘキソサミニダーゼ アルコールデヒドロゲナーゼ アルドースレダクターゼ アルデヒドレダクターゼ ソルビトールデヒドロゲナーゼ Na+/K+-ATPアーゼ |
| 血漿タンパク質 | アルブミン 免疫グロブリン アポA-Ⅰ アポA-Ⅱ アポB アポC-Ⅰ アポE ハプトグロビン フェリチン トランスフェリン α1-アンチトリプシン プラスミノーゲン プラスミノーゲンアクチベータ フィブリノーゲン フィブリン アンチトロンビンⅢ β2-ミクログロビン セルロプラスミン |
| ホルモン | 甲状腺ホルモン インスリン |
(谷口,蛋白の糖化(医学書院)より)
フロシンはアマドリ化合物を塩酸中で加水分解した時に得られる物質で、反応液をHPLCにより分離定量する。本方法は前処理に18時間を要する欠点がある。
フルクトサミン(FRA)は血漿中の糖化タンパクの総称で、アマドリ化合物(ケトアミン)が持つ還元能の測定値である。測定はアルカリ溶液中で血漿とニトロテトラゾリウムブルー(NBT)を共存させた時の色変化(青→青紫色)を糖化ポリリジンの活性を基準に比色定量する。FRAは測定法が簡便である反面、測定対象とするタンパク質の種類を特定できないことや、血漿タンパク量および共存する還元性物質影響を受け易い欠点がある。
グリコアルブミンは、血漿中のアルブミンが糖化したもので、アルブミン分子内の数個のアミノ酸にグルコースが結合したアマドリ化合物である。ボロン酸アフィニティクロマトグラフィー、標識免疫、色素吸着および糖化アミノ酸分解酵素法によって糖化率(%)が測定される。本測定法は測定対象とするタンパク種をアルブミンに特定できるため、アルブミンの半減期から過去2~4週間の血糖値推定に利用されている。
グリコヘモグロビンは、赤血球中のヘモグロビンが糖化したもので、特にヘモグロビンβ鎖N末端のバリンが糖化したものをHbA1c(ヘモグロビン・エイワンシー)と呼び、糖化率(%)として測定される。HPLC、陽イオン交換カラムクロマトグラフィー、アガロース電気泳動、等電点電気泳動、標識免疫および糖化アミノ酸分解酵素法によって測定される。本測定法は測定対象をヘモグロビンに特定できるため、赤血球の半減期から過去1~2ヵ月の血糖値推定に利用され、特にHbA1cが糖尿病患者の病態管理に最も良く利用されている。
後期反応中間体
糖化反応の前期段階は糖濃度や時間に依存した反応として理解されている。しかしアマドリ化合物から糖化反応最終生成物(AGEs)の生成過程である後期反応は、複雑で未だ解明されていない点が多い。
3DG(3-deoxyglucosne)は反応性の高いカルボニル基を分子内に2つ有する不安定な化合物であるが2,3-diaminonaphthaleneと反応すると非常に安定な誘導体を形成する。本誘導体は疎水性と高いモル吸光係数を有するため、逆相HPLCにより分離定量することで、血中の3DGを特異的かつ高感度(数10nmol/Lレベル)に測定できるようになった(図1)。また、3DGのイミダゾロン誘導体に対するモノクローナル抗体も市販されており、組織染色法による3DGの組織内蓄積の研究も行われている。
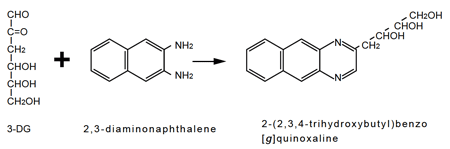
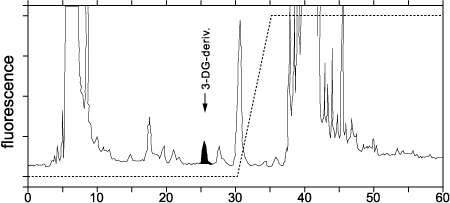
図1.HPLCによる3-デオキシグルコソンの測定クロマトグラム
カラム:TSK ODS-80TM(4.6 x250mm)
溶離液:50mmol/Lリン酸緩衝液/アセトニトリル/メタノール(70/15/15→20/40/40)
流速:1.0mL/min, 検出:蛍光(ex.271nm, em.503nm)
(楠と宮田,DOJIN NEWS 98 (2001)より)
糖化反応最終生成物(AGEs)
後期反応では多岐に渡る反応経路から、単一ではなく様々な物質が生成し、その総称としてAGEsと呼ばれている。またAGEsは黄褐色で蛍光性を持ち、タンパク質間に架橋を形成する物理化学的特性と血管内皮細胞やマクロファージに認識される生物学的特性を持つとされる。
初期のAGEs測定には蛍光特性を利用した蛍光測定法(主に、Ex: 370nm、Em: 440nm)が用いられてきた。しかし蛍光波長の異なるAGEs(ペントシジン:ex335nm, em385nm)や蛍光特性を持たないAGEs(ピラリン、CMLなど)が確認され、AGEsの総量を測定することは困難である(図2)。
| AGEs | 蛍光性 | 架橋構造 | 主要前駆体 |
| ペントシジン クロスリン ピロピリジン ピラリン カルボキシメチルリジン カルボキシエチルリジン アルグピリミジン イミダゾロン化合物 GOLD MOLD |
+ + + - - - - - - - |
+ + + - - - - - + + |
五炭糖, Vit.C グルコース 3-DG 3-DG アマドリ化合物, GO MG MG 3-DG, MG GO MG |
Vit.C:ビタミンC, 3-DG:3-デオキシグルコソン, GO:グリオキサール, MG:メチルグリオキサール,
GOLD:glyoxal-lysine dimer, MOLD:methyl-glyoxal-lysine dimer
(濱田と宮田,AGEs研究の最前線(メディカルレビュー社)より)
一方、近年各種AGEsの化学構造が解明されたことや抗体作成技術の進歩によって、HPLC、LC/MS/MS、酵素免疫測定法(ELISA)による、CML、ピラリン、ペントシジン、クロスリンなど、個別AGEの測定法が確立された。2006年1月にはELISA法による血中ペントシジン測定が腎機能検査項目において保険収載(実施料130点)され、臨床検査として測定されるようになった。
さらに皮膚中AGEs由来の蛍光を非侵襲で測定するシステムが、オランダのDiagnOptics社で製品化され、皮膚中AGEsと血液・組織中のAGEs量の相関から糖尿病合併症等の進展をモニタリングする方法として注目されている。
生体中糖化反応のモニタリングは、アルブミンとヘモグロビン由来の前期反応生成物を除いて一般的でなく、研究機関によって測定方法も異なっている。さらに市販の標準物質も少ない。また、抗体作成に使用された抗原(AGEsを含む反応液)の調製条件によっては、酵素免疫測定法によるAGEsの認識能(特異性)に違いがある点など課題が多い。
参考文献
-
- 繁田幸雄ら(編), 蛋白の糖化 AGEの基礎と臨床, 163pp, 医学書院, 1997.
- 山岸昌一(編), AGEs研究の最前線 糖化蛋白関連疾患研究の現状, 231pp, メディカルレビュー社, 2004.
- 金井正光(編著), 臨床検査法提要, 1847pp, 金原出版, 1996.
- 伏見製薬所 衛生検査センター(http://www.fushimi.co.jp/clinicallaboratory/)
- DiagnOptics(http://www.diagnoptics.com/)
糖化と抗糖化 詳細目次
- 生体内糖化反応とAGEs
- 生体中糖化反応のモニタリング
- AGEsとポリオール代謝経路
- 糖化と糖尿病合併症
- 糖化と動脈硬化
- 糖化と骨疾患、アルツハイマー病
- 糖化と皮膚老化
- 糖化反応阻害剤(合成化合物、既存医薬品)
- 糖化反応阻害剤(ビタミン類、その他の物質)
- 天然物中の糖化反応阻害成分
- アンチエイジングと抗糖化
– 学術術情報一覧
