学術情報
糖化ストレス対策 (2)糖化反応の抑制
糖化ストレス対策 (2)糖化反応の抑制
生体内糖化反応
生体中ではアミノ酸や蛋白と主にグルコースなどの還元糖が非酵素的に反応し、シッフ塩基(schiff base)の形成を経てアマドリ転移(amadori rearrangement)によって糖化蛋白(glycated protein)であるアマドリ化合物(amadori product)となり、不可逆的な物質になる。
アマドリ化合物は3-デオキシグルコソン(3-deoxyglucosone:3DG)、グリオキサール(glyoxal)、メチルグリオキサール(methylglyoxal)、グリセルアルデヒド(glyceraldehyde)、グルタルアルデヒド(glutaraldehyde)などのカルボニル化合物(carbonyl product)を中心とする中間体生成を経て、糖化最終生成物(advanced glycation endproducts:AGEs)の生成に至る。狭義の糖化反応はこれら一連の反応過程を意味する。
AGEsは血中のグルコースだけでなく、アルコール代謝や脂質酸化によって生成するアルデヒドやケトンと蛋白との間に生じるカルボニル化(carbonylation)によっても生成する。このためAGEsには生成経路の異なる多種類の物質が存在する(図1)1)。
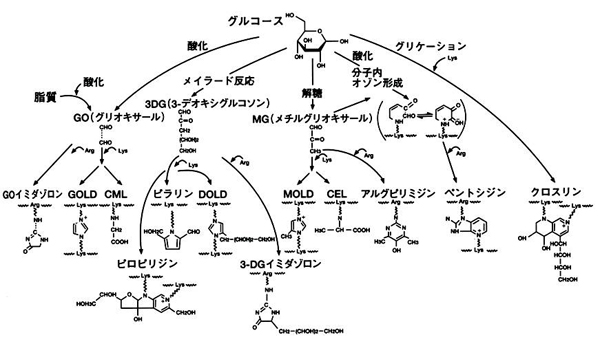
図1. 生体中AGEsの生成経路 1)
AGEsには蛍光性と非蛍光性物質がある。蛍光性AGEsにはペントシジン(pentosidine)、クロスリン(crossline)、ピロピリジン(pyrropyridine)などがある。非蛍光性のAGEsにはNε-(carboxymethyl)lysine(CML)、Nω-(carboxymethyl) arginine(CMA)などがある。またペントシジン、クロスリンなどは蛋白架橋性を有するため、蛋白のAGEs化が組織の物理的変化をもたらす。AGEsは受容体であるRAGE(receptor for AGEs)と結合すると細胞内シグナルを活性化し、炎症性サイトカイン生成を惹起する。このため生体中のAGEs生成・蓄積はさまざまな細胞や組織に障害を起こす。
還元糖やアルデヒド負荷に起因する生体ストレスと、その後の反応を総合的に捉えた概念は糖化ストレス(glycation stress)と呼ばれる。糖化ストレス対策のひとつには、これら生体内糖化反応の抑制がある。
天然物のin vitro糖化反応抑制作用
糖化反応抑制作用はヒト血清アルブミン(HSA)やコラーゲンなどの各種蛋白とグルコース反応系に様々な被験物質を添加し、反応液中の糖化反応中間体や各種AGEsの生成量値から算出した被験物質のIC50(50%生成阻害濃度:50% inhibitory concentration)で評価できる 2)。
糖化反応抑制作用の陽性対象としては糖化反応阻害剤であるアミノグアニジン (aminoguanidine)が汎用される。本評価系により、混合ハーブ 3)、紫菊花 4)、クマイザサ5)、健康茶 6)、フルーツ 7)、野菜 8)など、の多くの素材に糖化反応抑制作用が確認されている。
植物中の糖化反応抑制作用は主にポリフェノール類によるものと推定されている。糖化反応抑制作用物質としてはケイヒ酸(cinnamic acid)や安息香酸(benzoic acid)類縁体などのフェノール酸(phenolic acids)(図2)、フラボノイド(flavonoids)(図3)、フラボノイド(flavonoids)(図3)、イソフラボン(isoflavones)、プロシアニジン(procyanidins)(図4)などが報告されている 9)。さらに、その他のフェノール性化合物、テルペン(terpenes)、カロテノイド(carotenoids)、不飽和脂肪酸、多糖類、メラノイジン(melanoidine)やビタミン類にも糖化反応抑制作用がある。
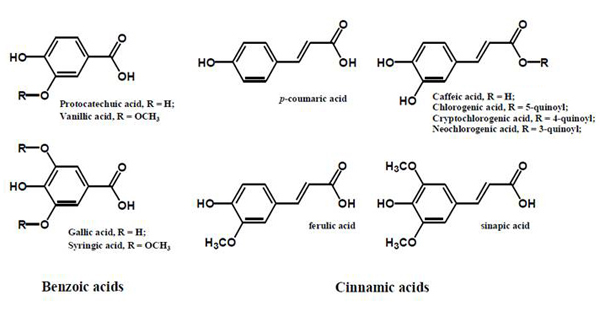
図2. 植物に含まれるフェノール酸 9)

図3. 植物に含まれるフラボノイド9)
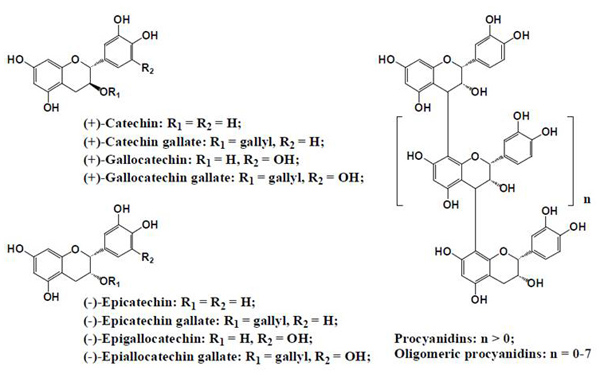
図4. 植物に含まれるプロシアニジン9)
植物素材中には、in vitroまたは動物実験によって抗糖化作用の存在が数多く報告されている。これらの作用は主にポリフェノール類が関与している。植物に含まれるポリフェノールの分布は進化や分類との関係が深く、化学的植物分類学(chemotaxonomy)の指標の一つになっている。分類学的に同じ科(family)または連(tribe)に属する植物には、類似構造のポリフェノールが含まれることが予想される 10)。一方、生体中におけるAGEs生成経路は多経路でバイパスや分岐を伴い、さらに糖化と酸化反応が複雑に絡み合っている(図1)。このため生体中で有用な糖化反応抑制作用を得るには、複数の成分が同時に多経路を阻害する必要がある。このため糖化反応抑制作用を効果的に得るには、植物素材の選定や組み合わせに植物分類学的な知見を考慮する必要がある。
混合ハーブエキスのin vitro糖化反応抑制作用
混合ハーブエキスは日本人に馴染み深く、食経験豊富で、植物分類学的に異なる植物種であるドクダミ(Houttuynia cordata)の地上部、セイヨウサンザシ(Crataegus oxyacantha)の果実、ローマカミツレ(Chamaemelum nobile)の花、ブドウ(Vitis vinifera)の葉の熱水抽出物が、蛍光性AGEs、3DG、ペントシジン、CML生成抑制作用が異なることに着目してブレンドされた糖化反応抑制素材のひとつである。混合ハーブエキスは機能性食品素材として2006年にアークレイ株式会社から「AGハーブMIXTM」として製品化されている 11)。糖化反応抑制作用成分の一つはローマカミツレ中のカマメロサイド(chamaemeloside: apigenin 7-O-β-D-glucopyranoside-6’’-(3’’’-hydroxy-3’’’-methylglutarate))であることが確認されている 12)。
混合ハーブエキスはin vitro糖化反応評価試験系において、蛍光性AGEs、3DG、CMLの生成を濃度依存的に抑制する。その作用はCMLとペントシジン生成をアミノグアニジンと比べて強く抑制する。また混合ハーブエキスはHSAと同様にコラーゲンに対しても蛍光性AGEsの生成を抑制し、さらにコラーゲン中に特異的に生成するCMAの生成も抑制する。混合ハーブエキスはin vitro糖化反応系においてアミノグアニジンと同等以上の糖化反応抑制作用を示しながら多経路の糖化反応を阻害し、複雑な生体内糖化反応を効果的に抑制する可能性が示唆されている。
ストレプトゾトシン誘発糖尿病ラットに対する混合ハーブエキスの作用 13)
本動物試験では6週齢の雄性Sprague-Dawley系ラットを7匹ずつコントロール群(G1)、ストレプトゾトシン(STZ)投与群(G2)、混合ハーブエキス投与群(G3)、アミノグアニジン投与群(G4)の4群に完全無作為化法により分け、G2~G4群の各個体には体重当たり55 mg/kg STZ を尾静脈内に単回で投与し、糖尿病を誘発させて12週間飼育された。飼料はG1、G2に対してマウス・ラット飼育用MF粉末飼料(MF)を、G3、G4群に対してMFに混合ハーブエキスまたはアミノグアニジンを混合した飼料が投与された。
この結果、混合ハーブエキス群(G3)とアミノグアニジン群(G4)は共に、STZ投与群(G2)に比べて血清ペントシジンおよびCMLの増加抑制傾向が見られた。また腎湿重量の増加抑制傾向も示した。混合ハーブエキスはSTZ誘発糖尿病ラットに対してアミノグアニジンと同等以上の糖化反応抑制作用を有し、糖尿病合併症進展リスクの低減および老化進展予防効果が期待された。
糖尿病予備群を対象とした混合ハーブエキスの摂取試験 14)
本ヒト臨床試験では糖尿病予備群(随時血糖値が 110~199 mg/dL かつ HbA1c(JDS値) が 5.5~6.5%の方)の成人男女26名が、試験食摂取群13名とプラセボ食摂取群13名に割り付けられ、混合ハーブエキスを 3,000 mg/日(摂取目安量の5倍)または同量のプラセボ食を8週間連続摂取した。各被験者は被験食摂取前、8週間後に採血し、血中の糖化反応生成物として3DG、CMLが測定された。なお本臨床試験はヘルシンキ宣言の精神に則り倫理委員会の承認を経て行なわれた。被験者は試験の内容を十分に理解し、同意書を提出して自主的に参加した。
摂取期間中は肝機能、腎機能、糖・脂質代謝機能検査などにおいて、混合ハーブエキスの摂取が原因と推定される有害事象(健康状態の変化)は認められず、食品としての摂取安全性が確認された。さらに摂取前と8週間後の血中AGEs値を測定比較した結果、試験食摂取群はプラセボ食摂取群と比較して、血糖値 110 mg/dL以上のサブグループ解析において血中3DGに増加抑制(p = 0.094)、HbA1c(JDS値)5.9%以上のサブグループ解析においてCMLに有意な減少(p = 0.048)が認められた。この結果、混合ハーブエキスはヒトにおいて糖代謝異常に伴って生成する糖化反応中間体やAGEsの生成を抑制することが示唆された。
糖尿病患者に対する混合ハーブエキスの摂取試験 15)
本ヒト臨床試験では成人男女7名の2型糖尿病患者(HbA1c(JDS値): 5.7~9.2%)が、試験食として混合ハーブエキスを 600 mg/日、12週間連続摂取した。各被験者には被験食摂取前、8週、12週間後に採血し、血中の糖化反応生成物として3DG、CMLが測定された。摂取前および摂取2、4、8、12週間後にはキュートメーターによって皮膚弾力性が測定された。なお本臨床試験はヘルシンキ宣言の精神に則り倫理委員会の承認を経て行なわれた。被験者は試験の内容を十分に理解し、同意書を提出して自主的に参加した。
摂取期間中は肝機能、腎機能、糖・脂質代謝機能検査などにおいて、混合ハーブエキスの摂取が原因と推定される有害事象(健康状態の変化)は認められず、食品としての摂取安全性が確認された。さらに、摂取前と比べて8、12週間後に3DGが有意に減少し(p < 0.001)、12週間後にCMLが有意に減少した(p < 0.001)。これらの結果は、既にin vitroおよび動物実験で確認した混合ハーブエキスの糖化反応抑制作用がヒトに対しても有効であることを示唆した。また、皮膚弾力性は摂取前と比べて8週間後(p = 0.001)、12週間後(p < 0.001)に皮膚弾力指数(R2:Ua/Uf)が有意に改善した。皮膚弾力性の改善は混合ハーブエキスの摂取が架橋性AGEsの生成を抑制した結果、蛋白の硬化を抑制し、皮膚ターンオーバーを経て弾力性の改善として作用したと考えられている。
混合ハーブエキスの皮膚中AGEs蓄積抑制作用 16)
本ヒト臨床試験では健常者群8名と糖尿病・高血糖群4名の成人男女が、混合ハーブエキスを 600 mg/日および生姜、山椒を配合した試験食を12週間連続摂取し、摂取前および8、12週間後にAGE ReaderによってAGEs蓄積量が測定された。なお本臨床試験はヘルシンキ宣言の精神に則り倫理委員会の承認を経て行なわれた。被験者は試験の内容を十分に理解し、同意書を提出して自主的に参加した。
摂取期間中は肝機能、腎機能、糖・脂質代謝機能検査などにおいて、混合ハーブエキスの摂取が原因と推定される有害事象(健康状態の変化)は認められず、食品としての摂取安全性が確認された。さらに、摂取前と比べて健常者群で8週間後(p = 0.035)、12週間後(p = 0.020)に皮膚中AGEs蓄積量が有意に減少した。また糖尿病・高血糖群では4名中3名に減少が見られた。蛍光を有するAGEsには蛋白の架橋形成に関与するクロスリンやペントシジンなどが含まれることから、混合ハーブエキスの摂取が皮膚蛋白質のAGEs化による硬化などの老化を抑制する可能性が示唆されている。
植物素材のin vitro糖化反応抑制作用とヒトに対する糖化ストレス抑制作用
混合ハーブエキスではin vitroにおける糖化反応抑制作用と、これをヒトが摂取したときに同様の糖化ストレス抑制作用がみられた。これらは混合ハーブエキスがin vitro糖化反応系において多経路の糖化反応を阻害し、複雑な生体内糖化反応を効果的に抑制した可能性があった。
混合ハーブエキスと同様の結果はマンゴスチン(Garcinia mangostana)17) やザクロ (Punica granatum)18) の果実など、単一素材の抽出物でも得られている。マンゴスチンには多種類のタンニン(tannin)19)、フェノール酸(phenolic acid)20)、キサントン(xanthones) 類 21)、ザクロにエラジタンニン(ellagitannin)類 22)が含まれる。単一素材の作用による糖化反応抑制作用は、これらの物質が腸内細菌叢によって生体内に吸収されやすい多種類の低分子物質に分解され、多経路の糖化反応系に作用している可能性がある 23)。
糖化ストレス対策として糖化反応抑制作用を効果的に利用するには、素材の選択と組み合わせがポイントになる。
参考文献
- 三浦雅一ら:生体内AGEsの測定, AGEs研究の最前線. 2004, 37-50, メディカルレビュー.
- Hori M, et al.:Anti-Aging Medicine. 2012 ; 9 : 125-134.
- Yonei Y, et al.:Anti-Aging Medicine. 2008 ; 5 : 93-98.
- Yagi M, et al.:Anti-Aging Medicine. 2012 ; 9 : 61-74.
- 堀未央ら:同志社大学理工学研究. 2011 ; 52 : 61-67.
- Hori M, et al.:Anti-Aging Medicine. 2012 ; 9 : 135-148.
- Lanny P, et al.:Anti-Aging Medicine. 2013 ; 10 : 70-76.
- Ishioka Y, et al.:Glycative Stress Research. 2015 ; 2 : 22-34.
- Odjakova M, et al.:Glycosylation. 2012 : 223-256, InTech
- Robards K, et al.:Analyst. 1997 ; 122 : 11R-34R.
- 八木雅之ら:COSMETIC STAGE. 2011 ; 15 : 23-32.
- 八木雅之ら:aromatopia. 2007 ; l16 : 26-29.
- Yonei Y, et al.:Anti-Aging Medicine. 2008 ; 5 : 93-98.
- Yonei Y, et al.:Anti-Aging Medicine. 2010 ; 7 : 26-35.
- Kubo M, et al.:J Clin Biochem Nutr. 2008 ; 43(Suppl 1) : 66-69.
- 田村隆朗ら:同志社大学理工学研究報告. 2012 ; 52 : 244-252.
- Ohno R, et al.:J Clin Biochem Nutr. 2015 ; 57 : 27-32.
- Yagi M, et al.:Glycative Stress Research. 2014; 1 : 60-67.
- Moosophin K, et al.:KKU Res J. 2010 ; 15 : 377-384.
- Zadernowski R, et al.:Food Chemistry. 2009 ; 112 : 685–689.
- Shan T, et al.:Curr Mol Med. 2011 ; 11 : 666–677.
- Ito H, et al.:Food Chem. 2014 ; 152 : 323-330.
- Verzelloni E, et al.:Mol Nutr Food Res. 2011 ; 55 : S35-S43.
