学術情報
糖化ストレスと AGEs 受容体
糖化ストレスと AGEs 受容体
糖化ストレスの亢進により血中や組織中に AGEs が生成・蓄積すると生理的機能の低下や障害が進展する。近年、 AGEs が受容体を介して細胞内にシグナル伝達する経路の解明や AGEs をトラップして除去する受容体の存在が明らかになってきた(図1)1) 。
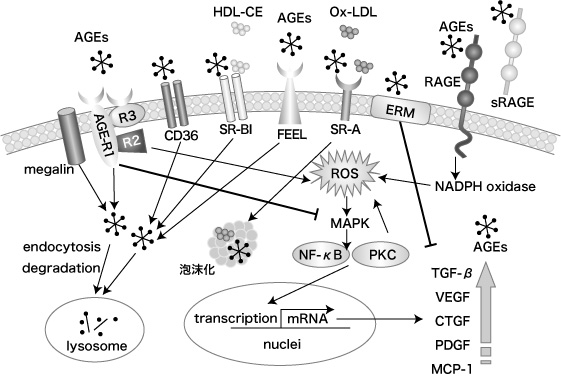
図1 AGEs受容体
深水圭ら (2013) 1)
AGEs の受容体は 1) 炎症に関与するもの、 2) AGEs の分解・除去に関与するもの、に大別される。 1) には receptor for AGEs(RAGE)、 AGE-R2 がある。 2) には AGE-R1、 AGE-R3、 CD36、 SR-A、 SR-BI、 FEEL-1,2、 ERM、メガリンがある。これらの受容体は血管、腎臓、神経、マクロファージ、造血幹細胞で発現している(表1)1) 。ここでは代表的な AGEs受容体とその機能をまとめた。
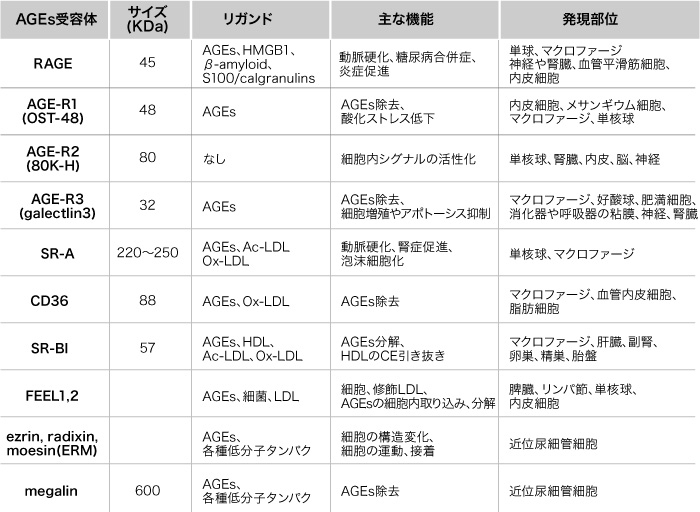
表1 AGEs受容体と機能
深水圭ら (2013) 1)
RAGE
RAGE は分子量 45kDa のイムノグロブリン・スーパーファミリーに属する一回膜貫通型の膜蛋白の一種で、単球、マクロファージ、神経、細尿管細胞、メサンギウム細胞などで発現している。 RAGE は AGEs 以外にアミロイドβ蛋白、 S100 / calgranulins や high mobility group box 1(HMGB-1)にも結合し、炎症や酸化ストレスの亢進に関与している。
RAGE は細胞外に存在する Vドメイン、 2つの Cドメイン、細胞膜貫通ドメイン、細胞内ドメインの 5つのドメインで構成されている(図2)。
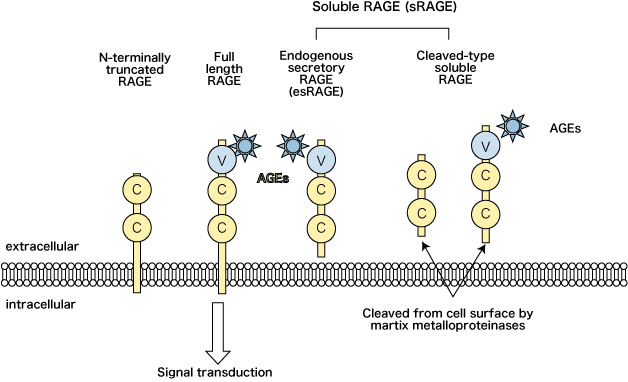
図2 RAGE とそのバリアント
RAGE = receptor for advanced glycation end-products; sRAGE = soluble form of RAGE; esRAGE = endogenous secretory RAGE; C = immunoglobulin-like constant domains; V = immunoglobulin-like variable domains
Katakami N, et al. (2007)12)
また RAGE には細胞表面に存在する全長型(full length RAGE : F-RAGE)以外に、スプライシングバリアント(splicing variant)として、細胞内ドメイン欠損型(C-terminally truncated RAGE : C-RAGE)、細胞外 Vドメイン欠損型(N-terminally truncated RAGE : N-RAGE)が存在する 3) 。
このうち細胞内ドメイン欠損型 RAGE は可溶性 RAGE (soluble RAGE : sRAGE)と呼ばれる。さらに sRAGE には細胞内で産生されて細胞外に分泌される endgenous secretory RAGE(esRAGE)と、 F-RAGE が蛋白分解酵素や matrix metalloproteinases(MMP)である a disintegrin and metalloproteinase 10(ADAM 10)によって切断されて血中に放出される cleaved-type soluble RAGE(CL-RAGE)が存在する 4) 。
F-RAGE は細胞膜上で AGEs と結合すると、 NADPHオキシダーゼが活性化し、細胞内酸化ストレスを亢進し、 NF-kB の活性化を介して、さまざまなサイトカイン、増殖因子の分泌、接着分子の発現亢進を誘導する 5)。また、酸化ストレスの亢進は、一酸化窒素(NO)を不活性化させ、炎症反応や血栓傾向をさらに増悪させて動脈硬化症の進展に関わるものと考えられる。
また AGEs は、血管内皮細胞における血管内皮増殖因子(VEGF)のオートクライン産生を促進し、血管新生を誘導する 6)。
さらに F-RAGE は AGEs と結合すると血管内皮細胞のプロスタサイクリン(PGI2)の産生を抑える一方、プラスミノーゲンアクチベーターインヒビター-1(PAI-1)の合成を促進し、線溶活性を阻害して血栓の安定化に関与する 7)。 AGEs は血小板の凝集を高めるとともに、凝固系のカスケードを促進させることも知られている。
一方、 sRAGE は AGEs との結合部位を持つため、細胞外に存在する AGEs を捕捉し、細胞表面に存在する RAGE との結合を阻害するデコイ受容体として機能すると考えられている 8)。 2型糖尿病患者では、血中 esRAGE が非糖尿病患者に比べて有意に低く、 2型糖尿病の発症に関与する可能性が示唆されている 9-10) 。また 1型糖尿患者では血中 esRAGE 濃度が低い症例で網膜症のリスクが高いとの報告がある(図3)11) 。さらに2型糖尿病患者の血中 esRAGE 濃度は、頸動脈硬化や冠動脈疾患の重症度と逆相関することも示されている 12-13) 。

図3 1型糖尿病患者における血清中 esRAGE と網膜症の関係
水平線は各群の平均値を示す ; Scheffe´’s F-test.
Sakurai S, et al. (2006)11)
AGE-R1, -R2, -R3 複合体
AGE-R1 は OST-48(oligosaccharyltransferase-48)とも呼ばれ、分子量 48kDa のレクチンファミリーに属する一回膜貫通型蛋白の一種である。 AGE-R1 は内皮細胞、メサンギウム細胞、マクロファージなどで発現し、エンドサイトーシス(endocytosis)によって AGEs を除去する。また AGE-R1 は寿命延長に関与している可能性がある 14) 。
AGE-R2 は 80K-H(80kDa protein kinase C substrate)とも呼ばれ、分子量 80kDa のチロシンリン酸化蛋白で細胞質に存在する。 AGE-R2 は単核球、腎臓、血管内皮、脳、神経などで発現し、細胞内シグナルの活性化に関与している。
AGE-R3 は galectin-3 とも呼ばれ、分子量 32kDa のレクチンファミリーに属する受容体である。 AGE-R3 は細胞上の炭水化物認識ドメインを介して AGEs と直接結合し、マクロファージ、好酸球、肥満細胞、神経、腎臓などで発現する。 AGE-R3 の作用には細胞とマトリックスであるラミニン(laminin)との接着抑制、肥満細胞の活性化、細胞増殖やアポトーシスの制御、エンドサイトーシスによる AGEs の分解などがある。さらに AGE-R3 は加齢や糖尿病において発現が増強することから、老化に対して保護的に働いている可能性がある 15) 。
SR-A、 CD36、 SR-BI、 FEEL-1、 FEEL-2
SR-A、 CD36、 SR-BI、 FEEL-1、 FEEL-2 はスカベンジャー受容体とも呼ばれ、 AGEs の分解排泄に作用している。
SR-A(scavenger receptor class A)はアセチル化LDL(low density lipoprotein)や酸化LDL をリガンドとして認識し、マクロファージの細胞表面で AGEs を細胞内に取り込んで泡沫化することから、動脈硬化の粥状化に関与することが示唆されている 16) 。
CD36(cluster of differentiation 36)はマクロファージ、血管内皮細胞、脂肪細胞表面で発現する。 CD36 は脂肪酸、コラーゲン、酸化LDL と結合し、酸化LDL のマクロファージ内への取り込みや脂肪酸を脂肪細胞に運搬する役割を担っている。 CD36 は AGEs を脂肪細胞内に取り込ませて AGEs を分解除去するため、動脈硬化に対して保護的な作用を及ぼすと推定されている 17)。
SR-BI(scavenger receptor-BI)はマクロファージ、肝臓、副腎、卵巣などで発現し、 HDL(high density lipoprotein)コレステロールエステルの肝臓への取り込みを促進する作用がある 18) 。
FEEL-1(fasciclin EFG-like laminin-type EGF-like and link domain-containing scavenger receptor-1)、 FEEL-2 は、脾臓、リンパ節に発現し、 AGEs の細胞内取り込み、分解に関与している 19)。
メガリン
メガリン(megalin)は分子量約 600kDa の糖蛋白で、 LDL受容体遺伝子ファミリーに属し、近位細尿管細胞に存在している20) 。メガリンは主にビタミンD 結合蛋白、レチノール結合蛋白、甲状腺ホルモン、インスリンなどの低分子蛋白の再吸収、代謝に関与している。近年、メガリンは in vitro 実験で AGE と結合することが証明され、糸球体を通過した AGEs がメガリンによってトラップされ、ライソソームに取り込まれて分解されることが報告されている 21) 。
その他の AGEs受容体
ERM 蛋白(ezrin, radixin, moesin)は細胞膜と細胞内アクチンフィラメントを連絡する蛋白で、細胞の運動、接着、構造変化などの役割を担っている。近年、 ERM ファミリー蛋白のN末端は AGEs と結合することが報告されている 22) 。
糖化ストレス抑制と AGEs 受容体
AGEs と RAGE の結合は細胞内の酸化ストレスを亢進し、サイトカインを発現させて細胞内に炎症を惹起し、臓器や組織障害を起こす。このため糖化ストレスを抑制には RAGE の発現抑制がターゲットのひとつとなる。一方、 AGE-R1 や AGE-R3 は臓器や組織を保護する役割を果たす。さらに sRAGE は AGEs に対してデコイ的に働き、 RAGE の発現による炎症惹起を抑制し、さまざまな疾患の進展を阻止する。このため AGEs を除去する受容体や sRAGE の発現制御は、今後の新たな糖化ストレス抑制手段になり得ると考えられる。
参考文献
-
- 深水圭ら : AGEs 受容体, AGEs と老化, 山岸昌一(編). 2013; 105-113. メディカルレビュー社(東京).
- Katakami N, et al. : Diabetes Vasc Dis Res. 2008; 5: 190-197.
- Sakurai S, et al. : J Am Soc Nephrol. 2003; 14: S259-S263.
- Rauuci A, et al. : FASEB J. 2008; 22: 3716-3727.
- Cipollone F, et al. : Circulation. 2003; 108: 1070-1077.
- Bucciarelli LG, et al. : Circulation. 2002; 106: 2827-2835.
- Soro-Paavoven A, et al. : Diabetes. 2008; 57: 2461-2469.
- Yonekura H, et al. : Biochem J. 2003; 370: 1097-1109.
- Koyama H, et al. : Arterioscler Thromb Vasc Biol. 2005; 25: 2587-2593.
- Choi KM, et al. : Int J Cardiol. 2009; 132: 96-101.
- Sakurai S, et al. : Diabetes Res Clin Pract. 2006; 73: 158-165.
- Katakami N, et al. : Atherosclerosis. 2007; 190: 22-23.
- Lu L, et al. : Atherosclerosis. 2009; 206: 540-545.
- Cai W, et al. : Circulation. 2004; 110: 285-291.
- Pugliese G, et al. : Diabetes. 2000; 49: 1249-1257.
- Nagai R, et al. : Diabetes. 2000; 49: 1714-1723.
- Ohgami N, et al. : J Biol Chem. 2001; 276: 3195-3202.
- Krieger M : J Clin Invest. 2001; 108: 793-797.
- Tamura Y, et al. : J Biol Chem. 2003; 278: 12613-12617.
- Farquhar MG, et al. : J Am Soc Nephrol. 1995; 6: 35-47.
- Saito A, et al. : J Am Soc Nephrol. 2003; 14: 2025-2032.
- McRobert EA, et al. : J Biol Chem. 2003; 278: 25783-25789.
